有机物A是重要的合成原料,在医药、染料、香料等行业有着广泛的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→G,G→麻黄碱的部分反应物和条件):
请回答下列问题:
(1)关于麻黄碱下列说法正确的是 (填字母)。
a.麻黄碱的分子式为C10H15NO
b.1mol麻黄碱可以对应消耗1molHCl或NaOH
c.麻黄碱可以发生消去和酯化反应
d.麻黄碱属于芳香烃
(2)已知有机物A的相对分子质量为106,A中含碳、氢、氧的质量之比为42:3:8,
则A的含氧官能团名称是 ;检验该官能团的实验是 。
(3)反应①~⑤中属于取代反应的是 (填序号)。
(4)写出D—B的化学方程式 。
(5)F可作多种香精的定香剂,请写出B和C反应生成F的化学方程式 。
(6)写出符合下列条件的同分异构体的结构简式 。
①与中间产物G互为同分异构体
②既能发生消去反应,又能发生酯化反应
③苯环上的一氯取代物只有两种,分子结构中没有甲基
(7)已知:
| |
溶解性 |
沸点 |
| A |
微溶于水 |
179.0℃ |
| E |
不溶于水 |
110.8℃ |
A可以由E制取,制取工艺中得到的是A、E混合物,分离该混合物的方法是 。
(1)实验室在配制氯化铁溶液时,常出现少许浑浊,原因离子方程式表示为 。为防止出现这样的现象,在配制时常加入
(2)根据下列2个热化学反应方程式:
FeO(s)+CO(g)=" Fe(s)+" CO2(g)△H= ―218kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H= +640.5kJ/mol
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学反应方程式:
______________
(4)常温下,等物质的量的浓度的①氨水②NH4HSO4③NH4Cl④(NH4)2CO3
⑤(NH4) 2SO4溶液中,c(NH4+)由大到小的顺序为_____________________________(填序号)
在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g)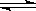 CO(g) + H2O(g)
CO(g) + H2O(g)
其平衡常数K和温度t的关系如下:
| t℃ |
700 |
800 |
850 |
1000 |
1200 |
| K |
2.6 |
1.7 |
1.0 |
0.9 |
0.6 |
(1)该反应的逆反应为 反应(“吸热”或“放热”);
(2)不能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(3) 在850℃时,可逆反应:CO2(g) + H2(g)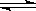 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min |
CO2 (mol/L) |
H2 (mol/L) |
CO (mol/L) |
H2O ( mol/L) |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
| 3 |
c1 |
c2 |
c3 |
c3 |
| 4 |
c1 |
c2 |
c3 |
c3 |
计算求出3min—4min达到平衡时CO的平衡浓度c3为(c3精确到小数点后面三位数); CO2 (g)的转化率为。
(10分)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2===2H2O.试回答下列问题:
(1)若电解质溶液为KOH溶液,构成燃料电池,则:
①负极反应式为________________,
②工作一段时间后,溶液pH________(填“增大”或“减小”或“不变”).
(2)如把KOH改为稀H2SO4作电解质,则:
①正极反应式为________________,
②工作一段时间后,溶液pH________(填“增大”或“减小”或“不变”).
(3)如把H2改为甲烷,KOH作电解质,则正极反应式为____________________.
已知H2A在水中存在以下平衡:H2A H++HA-,HA
H++HA-,HA H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是_____________________________ ___。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
A.c(H+)·c(OH-)=1×10-14 mol2·L-2 B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+) D.c (Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)  Ca2+(aq)+A2-(aq);ΔH>0。
Ca2+(aq)+A2-(aq);ΔH>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是
__________________________________________(用文字和离子方程式说明)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___________________________________________
(1)根据所学化学反应原理填空:
①升高温度时,水的pH(填“增大”“减小”或“不变”)
②体积、pH均相同的盐酸和醋酸溶液,中和等浓度的NaOH溶液时所需体积分别为V1、V2 。则V1V2(填“<”、“>”或“=”)
③某反应放热且熵增加,该反应自发进行(用“能”或“不能”表示)
(2)依据事实,用化学用语填空:
①1 mol NO2气体与水完全反应生成硝酸溶液和NO气体,放出热量46 kJ。该反应的热化学方程式______________________________________。
②用离子方程式表示氯化铵溶液的酸碱性:_。
③用离子方程式表示向碳酸镁沉淀中加入NaOH溶液后的沉淀转化:
。