有机物Ⅰ可以用E和H在一定条件下合成: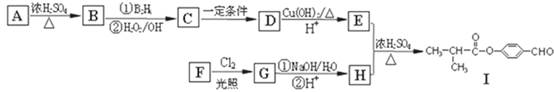
请根据以下信息完成下列问题:
①A为丁醇且核磁共振氢谱有2种不同化学环境的氢;
②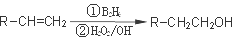
③一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)B的分子式为: 。
(2)C→D的反应类型为 。
(3)芳香族化合物F的分子式为C7H8O,苯环上的一氯代物只有两种,则F的结构简式为: 。
(4)D生成E的化学方程式为 。
E与H反应生成I的方程式为 。
(5)I的同系物K相对分子质量比I小28。K的结构中能同时满足如下条件:①苯环上只有两个取代基;②分子中不含甲基。共有 种(不考虑立体异构)。试写出上述同分异构体中任意一种消耗NaOH最多的有机物结构简式 。
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下: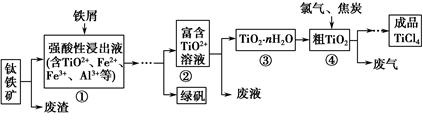
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K=。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用方法。
| TiCl4 |
SiCl4 |
|
| 熔点/℃ |
-25.0 |
-68.8 |
| 沸点/℃ |
136.4 |
57.6 |
某校化学研究性学习小组,在学习金属的冶炼以后对一氧化碳还原金属氧化物的实验非常感兴趣,他们查阅有关资料后发现,一氧化碳的制备可利用甲酸和浓硫酸共热到60~80 ℃发生脱水反应制取:
HCOOH CO↑+H2O
CO↑+H2O
请根据以下各图帮他们组装成一套相对合理的实验装置图(某些装置可重复使用)。
回答以下问题:
(1)合理实验装置的连接顺序是(写小写字母)。
(2)在反应时一定要先通一会一氧化碳气体,然后再点燃加热氧化铁的酒精灯,原因是。
| A.因为一般反应从左到右进行 |
| B.排除体系内的空气,使反应过程更安全 |
| C.甲酸与浓硫酸反应可以产生大量的CO |
| D.此反应加热时间长有利于产生CO |
(3)请说出你所选择的第一个NaOH洗气瓶的作用是。
(4)在观察到硬质玻璃管中的物质由色完全变为色时停止加热,然后继续,原因是防止铁被氧化。
(5)硬质玻璃管中发生反应的化学方程式为。
(6)该实验的一个优点是把实验过程中的尾气利用排水法收集起来,收集的气体前后有几瓶,分别按收集的先后顺序编号,点燃各个瓶中的气体,中间编号的集气瓶中气体,编号最先和最后的集气瓶中气体,原因是。
某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。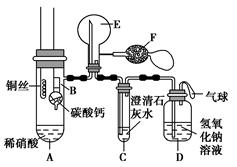
实验操作及现象:
| 实验操作 |
现象 |
| Ⅰ.将B装置下移,使碳酸钙与稀硝酸接触 |
产生气体 |
| Ⅱ.当C装置中产生白色沉淀时,立刻将B装置上提 |
|
| Ⅲ.将A装置中铜丝放入稀硝酸中,给A装置微微加热 |
A装置中产生无色气体 E装置中开始时出现浅红棕色气体 |
| Ⅳ.用F装置向E装置中鼓入空气 |
E装置内气体颜色逐渐加深 |
| Ⅴ.一段时间后 |
C装置中白色沉淀溶解 |
试回答下列问题:
(1)操作Ⅰ中产生气体的化学式为;操作Ⅰ的目的是;D装置的作用是。
(2)C装置中白色沉淀的化学式是,操作Ⅱ中当C装置中产生白色沉淀时立刻将B装置上提的原因是。
(3)操作Ⅲ中A装置中产生无色气体的化学方程式是。
(4)E装置内气体颜色逐渐加深的原因是。
(5)操作Ⅴ现象产生的原因是(用化学方程式说明)。
某兴趣小组的同学共同设计了如图所示的多功能实验装置。该装置既可用于制取气体,又可用于验证物质的性质。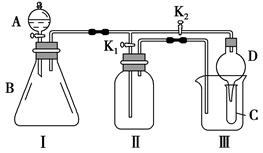
(1)现有以下药品:锌粒、铜片、浓H2SO4、浓HNO3、蒸馏水、NaOH溶液。打开K1,关闭K2,可制取气体。
(2)某同学用石灰石、醋酸、硅酸钠溶液等药品设计了另一实验。他的实验目的是;打开K2,关闭K1,将A中液体加入B中后,观察到的实验现象为。
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下: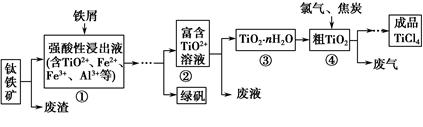
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K=。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用方法。
| TiCl4 |
SiCl4 |
|
| 熔点/℃ |
-25.0 |
-68.8 |
| 沸点/℃ |
136.4 |
57.6 |