短周期元素A、B、C、D位于同周期且原子序数依次增大。已知A、C、D三种元素原子的最外层共有10个电子,且这三种元素的最高价氧化物所对应的水化 物之间两两皆能反应,均生成盐和水。请完成下列各小题:
物之间两两皆能反应,均生成盐和水。请完成下列各小题:
(1)A、B、C三种阳离子的半径由大到小的顺序是: > > (填写离子符号)
(2)指出元素D在元素周期表中的位置:__________________________。
(3)元素B的氧化物属于 化合物(填“离子”或“共价”),其电子式为 。
(4)A、C元素的最高价氧化物所对应的水化物之间反应的离子方程式为 。
(5)含有C阳离子的盐常用来净化水,其原因为
。
(用离子方程式表示和适当的文字说明)
在一定温度下(已知在该温度下,容器内所有物质均为气态),10 L密闭容器中加入5 mol SO2.4 mol O2,经10 min后反应达平衡时有2 mol SO2发生了反应。试计算:
(1)用SO2表示该反应的反应速率;
(2)O2的转化率;
(3)该温度下的平衡常数K(保留三位有效数字)。
某有机物X(C12H13O6Br)的分子中含有多种官能团,其结构简式为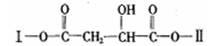
(其中Ⅰ、Ⅱ为未知部分的结构)。为推测X的分子结构,进行如图所示的转化: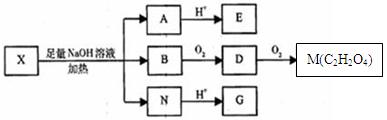
已知向E的水溶液中滴入FeCl3溶液发生显色反应;G、M都能与NaHCO3溶液反应;在X分子结构中,Ⅰ里含有能与FeCl3溶液发生显色反应的官能团,且E分子中苯环上的一氯代物只有一种。
⑴G分子所含官能团的名称是;G不能发生的反应有(选填序号)
| A.加成反应 | B.消去反应 | C.氧化反应 | D.取代反应 |
⑵X的结构简式是。
⑶由B转化成D的化学方程式是。(条件可以不写)
⑷F与G互为同分异构体,F的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基。则F的分子结构有种。
⑸X的核磁共振氢谱图中有个峰。
(Ⅰ)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
⑴丙烷脱氢可得丙烯。
已知:C3H8(g) CH4(g)+HC
CH4(g)+HC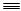 CH(g)+H2(g)
CH(g)+H2(g)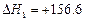 kJ/mol
kJ/mol
CH3CH CH2(g)
CH2(g) CH4(g)+HC
CH4(g)+HC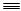 CH(g)
CH(g)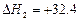 kJ/mol
kJ/mol
则相同条件下,反应C3H8(g) CH3CH
CH3CH CH2(g)+H2(g)的
CH2(g)+H2(g)的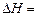 kJ/mol。
kJ/mol。
⑵以丙烷为燃料制作新型燃料电池,电池的一极通入O2和CO2,另一极通入丙烷,电解质是熔融碳酸盐。通丙烷的一极是电池的极,电池负极的电极反应式为;放电时,CO32-移向电池的(填“正”或“负”)极。
(Ⅱ)如下图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和物质的量浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。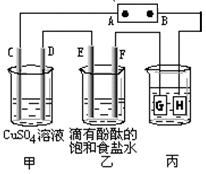
⑴A极是电源的极。
⑵若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为。
⑶现用丙装置给铜件镀银,则H应该是(填“镀层金属”或“镀件”),电镀液是溶液。
当乙中溶液的c(OH-)=0.1mol/L(此时乙溶液体积为500mL),丙中镀件上析出银的质量为,甲中溶液的c(H+)(填“变大”、“变小”或“不变”)。
⑷上图甲装置电解CuSO4溶液一段时间后,向所得溶液中加入0.2mol Cu(OH)2后,
恰好使溶液恢复到电解前的浓度。则乙装置中,若不考虑Cl2的溶解及与碱的反应,此装置共产生气体L(标准状况)。
下列各组物质属于同系物的是,属于同分异物体的是;属于同素异形体的是,属于同一种物质的是。(填序号)
⑴O2和O3⑵氕和氚⑶麦芽糖和蔗糖⑷苯和对二甲苯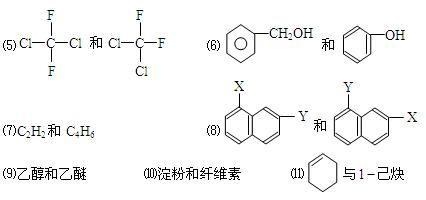
由CH3CH2Cl经过3步制乙二醇(HO CH2CH2OH,写出化学方程式,注明反应条件及反应类型:
(1)反应
(2)反应
(3)反应