设水的电离平衡线如下图所示。 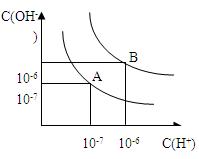
(1)若以A点表示25℃时水在电离平衡时的粒子浓度,当温度升高到100℃时,水的电离平衡状态到B点,则此时水的离子积从___________增加到____________;
(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持在100℃的恒温,欲使混合溶液的PH=7,则Ba(OH)2溶液和盐酸的体积比为__________。
(1)SO2和氮的氧化物都是空气中的有害气体,已知:
2SO2(g)+O2(g) 2SO3(g)ΔH=-196.6 kJ·mol-1
2SO3(g)ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH=-113.0 kJ·mol-1
2NO2(g)ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=________kJ·mol-1。
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
2CO(g)+SO2(g) 2CO2(g)+S(l)△H=—270 kJ/mol
2CO2(g)+S(l)△H=—270 kJ/mol
一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,在催化剂作用下发生反应生成CO2(g)和S(l)。
①若反应进行到25min时测得CO2的体积分数为0.5。则前25min的反应速率v(CO)=_____;
②若反应进行到40min时反应达到平衡状态,此时测得容器中气体的密度比反应前减少了12.8g/L,则化学平衡常数K=________;
③若反应在不同条件下进行,反应体系总压强随时间的变化如图甲所示:
图甲中三组实验从反应开始至达到平衡时的反应速率v(CO)由大到小的次序为_________(填实验序号);与实验a相比,c组改变的实验条件可能是__________;若用P0表示开始时总压强,P表示平衡时总压强,用α表示CO的平衡转化率,则α的表达式为______________。
(3)汽车尾气和工业废气中均含有的NO2,NO2是大气污染物之一。消除NO2的污染还可用电解法,方法之一是先将NO2转化为N2O4,然后采用电解法制备 N2O5,装置如图所示。 Pt乙为 极,电解池中生成N2O5的电极反应式是 。
酯类化合物在医药和涂料等应用广泛。
(1)某有机物X的结构简式如图所示,则下列有关说法正确的是
| A.X的分子式为C12H13O3 |
| B.1molX最多只能与含1molNaOH的溶液反应 |
| C.X在一定条件下能发生加成反应、加聚反应和酯化反应 |
| D.可用溴水区分苯酚和X |
(2)固定CO2能有效利用资源、减缓温室效应并制备某些酯类。某高分子F可用下列途径制得: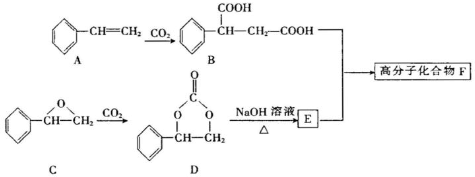
化合物B分子中官能团的名称为 ,0.1mol化合物A完全燃烧需要消耗 O2(标准状况下)。
(3)化合物A可由芳香族化合物Ⅰ或Ⅱ通过消去反应获得,其中化合物Ⅰ能发生催化氧化,其氧化产物能发生银镜反应,则化合物Ⅰ的结构简式为 ;由化合物Ⅱ生成化合物Ⅰ的反应条件为 。
(4)写出由D与足量NaOH溶液反应生成E的化学反应方程式: 。
(5)化合物Ⅲ的结构简式为 在一定条件下,化合物Ⅲ也能与CO2发生类似于化合物C与CO2反应生成D的反应,生成两种化合物(互为同分异构体),写出其中任意一种化合物的结构简式: 。
在一定条件下,化合物Ⅲ也能与CO2发生类似于化合物C与CO2反应生成D的反应,生成两种化合物(互为同分异构体),写出其中任意一种化合物的结构简式: 。
【化学-有机化学基础】(13分)某兴趣小组以烃M等为主要原料合成药物普鲁卡因: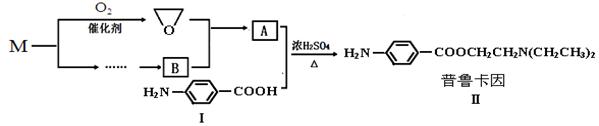
已知:①在标准状况下气体M的密度是1.25g/L。
②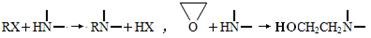 。
。
(1)M→ 的反应中原子利用率为100%,该反应的化学方程式为__________________,反应类型是___________。
的反应中原子利用率为100%,该反应的化学方程式为__________________,反应类型是___________。
(2)对于普鲁卡因,下列说法正确的是________。
| A.一个分子中有15个氢原子 |
| B.能与氢氧化钠溶液反应,但不与盐酸反应 |
| C.能发生加成反应、取代反应和氧化反应 |
| D.属于芳香族化合物 |
(3)A中含氧官能团的名称为 。化合物Ⅰ在浓H2SO4和加热的条件下,自身能反应生成高分子聚合物Ⅲ,写出Ⅲ的结构简式_____。
(4)符号下列条件的化合物Ⅰ的同分异构体有_______种。
①能发生银镜反应;
②遇氯化铁溶液显紫色
(5)请用化学反应方程式表示以M为原料制备B(无机试剂任选)的有关反应_______________。
【化学-物质结构与性质】(13分)X、Y、Z、W、Q五种元素的原子序数依次增大,已知X原子核外电子占3个不同能级,且每个能级上排布的电子数相同,Z原子L电子层上有2对成对电子,W元素的最高正价与最低负价的代数和为6,Q的+1价阳离子核外有3个电子层均处于全满状态。回答下列问题:
(1)X的基态原子最外层有____种不同运动状态的电子,Q+的基态核外电子排布式为_______;
(2)X、Y、Z三种元素的第一电离能由小到大的顺序为______(填元素符号),形成的最简单氢化物的熔点由低到高的顺序是_______(填化学式);
(3)YW3中心原子的杂化方式为________,其分子空间构型为________;
(4)X、Z两种元素形成的化合物XZ2分子中含有_____个σ键和______个π键;
(5)用晶体的x射线衍射法对Q的测定得到以下结果:Q的晶胞为面心立方最密堆积(如图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为____;Q的原子半径是_____(阿伏加德罗常数为NA)。
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。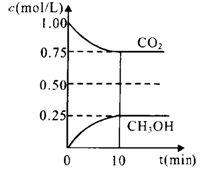
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。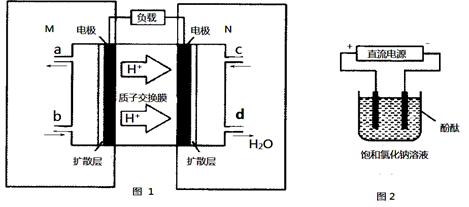
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-c kJ·mol-1;
H2O(g)=H2O(l)△H=-d kJ·mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________。