25℃时,在下列给定条件的溶液中,一定能大量共存的离子组是
A.pH=1的溶液中:Fe2+、NO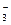 、SO 、SO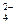 、Na+ 、Na+ |
B.c(Fe3+)=0.1mol·L-1的溶液中:K+、ClO-、SO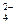 、SCN- 、SCN- |
C.c(H+)/c(OH-)=1012的溶液中:NH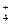 、Al3+、NO 、Al3+、NO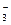 、Cl- 、Cl- |
D.由水电离出的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO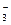 |
下列各组分子中,都属于含极性键的非极性分子的是
| A.C2H4 C6H6 | B.CO2 H2O2 |
| C.C60 C2H4 | D.NH3 HBr |
下列说法中正确的是
| A.s区都是金属元素 | B.s区都是主族元素 |
| C.稀有气体在ds区 | D.所有非金属元素都在p区 |
下列物质的性质与氢键无关的是
| A.冰的密度比液态水的密度小 |
| B.NH3易液化 |
| C.在相同条件下,H2O的沸点比H2S的沸点高 |
| D.HF分子比HCl分子稳定 |
下列物质中,中心原子的杂化类型为sp3杂化的是
| A.C2H6 | B.C2H2 | C.BF3 | D.C2H4 |
下列叙述错误的是
①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同
| A.①③ | B.②④ | C.②⑤ | D.④⑥ |