二次合金中含有金、银、铂、钯等贵重金属,实验室以二次合金为原料提取金、银、铂、钯等贵重金属的步骤如下,试回答下列问题:
(1)浓硫酸浸煮过程中产生尾气的主要成分是 (填写代号,下同),欲对该气体进行检验,最好的试剂是 ;
| A.H2 | B.SO2 | C.灼热的氧化铜粉末 | D.品红试剂 |
(2)操作Ⅰ的实验名称是 ,完成该实验需要的玻璃仪器有
(填写仪器名称);
(3)实验室制备的Cl2中混有水蒸气和HCl杂质,甲同学设计了如下图所示的实验装置来证明水蒸气和HCl杂质的存在,请根据甲同学的设计意图完成下列有关问题。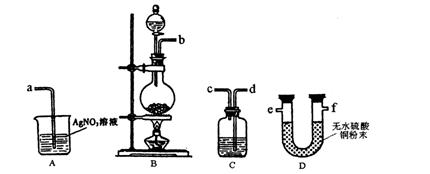
①各实验装置的接口顺序为:b接 , 接 , 接a;
②装置C的作用是 ;
③乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置E。你认为装置E应加在 之间(填装置序号),并且在广口瓶中放入 (填写所用试剂或用品名称)。
加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
【问题1】工业生产碘酸钾的流程如下:
(1)已知步骤①反应器发生的反应中,生成的两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式: 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ |
20 |
40 |
60 |
80 |
| KIO3g/100g水 |
8.08 |
12.6 |
18.3 |
24.8 |
【问题2】已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL
恰好反应完全。则加碘食盐样品中的碘元素含量是mg/kg(以含w的代数式表示)。
(3)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 |
实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 |
溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 |
溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡。 |
溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价:。
某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。
回答下列问题。
(1) 写出装置A中发生反应的离子方程式____________________
(2) 装置B中最适宜的试剂是 。
(3) 装置D中黑色固体为 (填名称),反应的化学方程式为 。
(4) 按照如图装置进行实验时,首先进行的操作是_____________
(5) 根据实验中的 现象,可证明CO具有还原性,有关反应的化学方程式是 。
(6) 若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置
与 之间连接下图中的 装置(填序号)。
某实验需要100 mL、1 mol/L的Na2CO3溶液,现通过如下操作配制:
① 把称量好的固体Na2CO3放入小烧杯中,加适量蒸馏水溶解。为加快溶解可以使用(填仪器名称)搅拌 ②把①所得溶液冷却到室温后,小心转入(填仪器名称)③继续加蒸馏水至液面至刻度线1~2cm处,改用(填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切 ④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入容量瓶,并轻轻摇匀 ⑤将容量瓶塞紧,充分摇匀。
(1)操作步骤正确的顺序是(填序号)。
(2)若没有操作④,则所配溶液的浓度会(填“偏高”或“偏低”)。
(3)若所配溶液的密度为1.06 g/mL,则该溶液的质量分数为。
(4)若取出20 mL配好Na2CO3的溶液,加蒸馏水稀释成c(Na+) ="0.01" mol/L的溶液,则稀释后溶液的体积为mL
(5)在配制100 mL、1 mol/L的Na2CO3溶液时,下列操作中的会导致结果偏低(请用序号填写)
①用拖盘天平称量时砝码放在左盘
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④定容时仰视刻度线
⑤干净的容量瓶未经干燥就用于配制溶液
工业生产的纯碱中常含有少量NaCl杂质。为测定某纯碱样品的纯度,化学课外活动小组设计了三种实验方案:
【方案一】取样品溶解后,加试剂使CO32-沉淀,测定沉淀的质量。
【方案二】用0.100 mol/L盐酸滴定。
【方案三】用稀酸将CO32-转化为CO2,测定CO2的质量。
解答1-4小题:
1.方案一的操作步骤有:①称量并溶解样品;②加入足量的BaCl2溶液;③过滤;④洗涤;⑤干燥;⑥称量并进行恒重操作。称量时所需定量实验仪器为____________________。判断是否达到恒重的标准是_____________________________________________________。
2.方案二的具体过程为:
①操作1所需要的仪器有_____________________________________________。
②滴定时选择的指示剂为甲基橙。当溶液____________________________________时,说明达到了滴定终点。
③为减少偶然误差,通常的处理办法是_______________________________。
④滴定时若锥形瓶内有少量液体溅出,则测定结果_________。(选填“偏高”、“偏低”、“不影响”,下同),若盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗,测定结果_________。
3.方案三的实验装置如下图: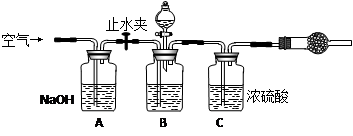
操作步骤有:①检查装置的气密性;②在干燥管内装满碱石灰,称量质量为W1 g;③称量W2 g样品装入广口瓶B中;④关闭止水夹;⑤缓慢加入稀H2SO4至不再产生气体为止;⑥ 打开止水夹;⑦缓缓鼓入空气数分钟,再称量干燥管,质量为W3 g。
该方案样品中纯碱的质量分数为__________________________(用代数式表示)。
上图中装置A的作用是_____________________。装置C的作用是_____________________。有同学认为空气中的水蒸气会进入干燥管导致测量结果_____________(填“偏大”、“偏小”或“无影响”)。改进措施可以是______________________________________________。
4.若用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量。则下列装置中,最合理的是______。(选填序号)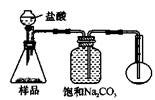

A B

C D
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
⑴ 若A是一种黄色单质固体,则B→C的化学方程式为。
⑵ 若A是一种活泼金属,C是淡黄色固体,则C的名称为,C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用,请用化学方程式表示该反应原理。
⑶若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体,且B和C易在空气形成光化学烟雾。
①则A为,C为,(填写化学式)
实验室用熟石灰与氯化铵固体共热制取A,写出此化学方程式:。
②写出C与水反应的化学方程式:。