加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
【问题1】工业生产碘酸钾的流程如下: 
(1)已知步骤①反应器发生的反应中,生成的两种还原产物所得电子数相同。请写出反应器中发生反应的化学方程式: 。
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法是 。
| 温度/℃ |
20 |
40 |
60 |
80 |
| KIO3g/100g水 |
8.08 |
12.6 |
18.3 |
24.8 |
【问题2】已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-。
(1)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有 。
(2)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL
恰好反应完全。则加碘食盐样品中的碘元素含量是 mg/kg(以含w的代数式表示)。
(3)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 |
实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 |
溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 |
溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡。 |
溶液变蓝色 |
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价: 。
W、X、Y、Z是短周期中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X原子最外层电子数等于电子层数,Z元素的最高价氧化物的水化物的酸性是最强的。
(1)W位于元素周期表第______周期第______族。W的气态氢化物稳定性比 ______(填“强”或“弱”)。
______(填“强”或“弱”)。
(2)Y有两种常见的氧化物,能同时使溴水和酸性高锰酸钾溶液褪色的是(写化学式),并写出这两个离子方程式:
_______________________________________________________________________
________________________________________________________________________
(3) 实验室制取Z的单质的化学方程式是:_______________________________________。
实验室制取Z的单质的化学方程式是:_______________________________________。



X的单质和FeO反应的热化学方程式是_________________________________________。
为测定某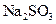 样品(含少量
样品(含少量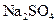 杂质)的纯度,实验室按以下步骤进行:①称取
杂质)的纯度,实验室按以下步骤进行:①称取
 样品,置于烧杯中;
样品,置于烧杯中;
②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:
| 方法一 |
方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量 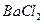 溶液,充分搅拌,使沉淀完全; 溶液,充分搅拌,使沉淀完全;⑥过滤、洗涤、干燥沉淀、称量得到bg固体。 |
④将25.00mL溶液置于锥形瓶中; ⑤用0.1 mol 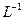 的酸性 的酸性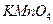 溶液进行滴定,达到滴定终点时,消耗10.00mL溶液。 溶液进行滴定,达到滴定终点时,消耗10.00mL溶液。 |
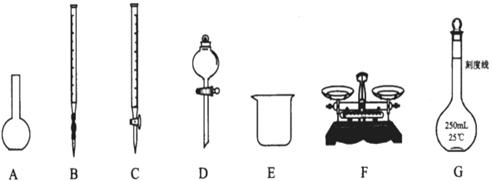
请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的的仪器是E和_______(填字母);
(2)在方法一④中加入过量稀盐酸的目的是____________________________________;
(3)在方法一测定得到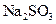 样品的纯度是______________(列出算式,可不化简);
样品的纯度是______________(列出算式,可不化简);
(4)在方法二中,是否需要加入指示剂________(填“是”或“否”),请简述理由___
____________________________ ______________________________________;
______________________________________;
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果___________________(填“偏高”、“偏低”、“无影响”)。
无水硫酸铜在加热条件下能发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。某学生试图用下图所示装置来确定该化学反应中各物质的计量关系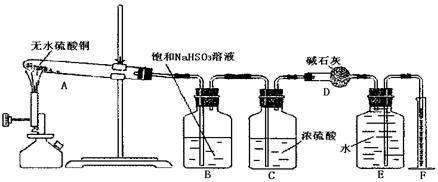
试回答:
(1)加热过程中,试管A中发生的实验现象为。
(2)装置E和F的作用是;
(3)该学生使用装置B的本意是除去混合气体中的三氧化硫以提纯氧气,他的做法正确
吗?为什么?
(4)该学生利用上述装置将一定质量的无水硫酸铜置于A中加热使其分解,最后测得氧
气的体积偏小,其原因可能是 (填序号)
| A.无水硫酸铜未完全分解o*m |
| B.实验结束时装置A中残留有气体 |
C. 被 被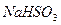 溶液吸收时产生了 溶液吸收时产生了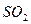 气体 气体 |
| D.最后读量筒中的读数时,E中的液面低于F中的液面 |
(5)另一学生将4.8g无水硫酸铜充分加热使其完全分解后,用正确的实验方法除去了生成物中的二氧化硫和三氧化硫,最后测 出氧气的体积为224mL(标准状况)。据此可计算出二氧化硫为mol,三氧化硫为mol。
出氧气的体积为224mL(标准状况)。据此可计算出二氧化硫为mol,三氧化硫为mol。
(6)由上述实验数据可知无水硫酸铜受热分解的化学方程式为:
___________________________________________________________________
实验室里用乙醇和浓硫酸反应生成乙烯,进而制取1,2-二溴乙烷。
(1)用下列仪器(短接 口或橡皮管均已略去)完成该实验,若气体流向为从左到右,则正确的连接顺序是:
口或橡皮管均已略去)完成该实验,若气体流向为从左到右,则正确的连接顺序是:
B经A(1)插入A中,D接A(2);A(3)接______接______接______接______。
(2)温度计水银球的正确位置是___________ ____________________。
____________________。
(3)D与分液漏斗相比,其主要优点是________________________________。
(4)E装置烧杯中的冷水和反应管内液溴上的水层作用均是________________,若将装置F拆除,在E中的主要副反应为_________________________________。
(5)若要准确测定乙烯的产量,下列方案可行的是_____________________。
方案I:将E及其后面的装置拆除后,连接图28—1所示装置进行实 验,反应结束后,测其实验前后的质量,由此得到乙烯产量。
验,反应结束后,测其实验前后的质量,由此得到乙烯产量。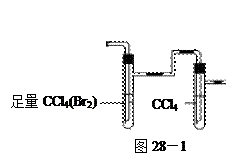 方案II:将E及其后面的装置拆除后,连接图28—2所示装置进行实验,反应结束后,测得乙烯的体积,由此算得乙烯产量。
方案II:将E及其后面的装置拆除后,连接图28—2所示装置进行实验,反应结束后,测得乙烯的体积,由此算得乙烯产量。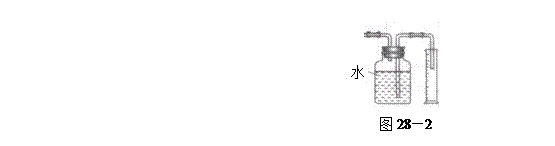
某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。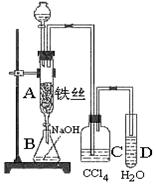
(1)写出A中反应的化学方程式:。
(2)观察到A中的现象是。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是,写出有关的化学方程式。
(4)C中盛放CCl4的作用是。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入,现象是。