某研究性学习小组进行溴乙烷的制备及性质探究实验。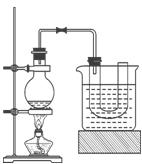
探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
| A.氢氧化钠稀溶液 | B.碳酸钠稀溶液 |
| C.硝酸银溶液 | D.四氯化碳 |
探究二:学习小组在进行溴乙烷与NaOH乙醇溶液的反应实验中,观察到有气体生成。他们设计了两种不同的方法分别检验该气体,实验装置如图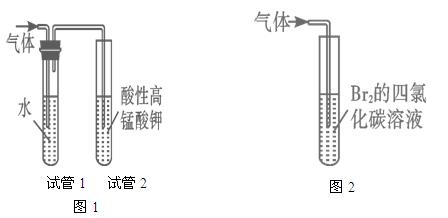
请回答:
(5)图1中,试管1的作用是:________________________________;
图2中发生的反应是:________________________________(用化学方程式表示)。
制备溴苯的实验装置如图所示,回答下列问题:
(1)装在左侧分液漏斗中的药品是。
(2)反应方程式。
(3)将左侧分液漏斗的旋纽打开后,在A中可观察到的现象是。
(4)冷凝管B有上、下两口,冷却水应从口进入。
(5)右侧分液漏斗中的物质在什么时候加入A中?。其作用是。
(6)要证明该反应是取代反应,最方便的实验方法是 。
。
(8分)欲配制100mL 0.2mol/L的NaOH溶液,回答下列问题:
(1) (2分)根据计算,所需的NaOH的质量为,NaOH固体应放在中称量。(2) (3分)以下是实验操作步 骤,请排出正确的操作顺序:
骤,请排出正确的操作顺序:
①称取所需质量的NaOH
②将溶液转移到容量瓶内
③用蒸馏水洗涤烧杯2~3次,将洗涤液全部移入容量瓶中,摇匀
④改用胶头滴管,小心滴入蒸馏水至刻度
⑤仔细地把蒸馏水注入容量瓶中,直到液面接近刻度线1cm~2cm处
⑥塞上瓶塞。反复摇匀
⑦将称取的NaOH置于烧杯内,加适量蒸馏水,搅拌溶解后冷却
正确的操作顺序是:
(3) (3分)下列操作会使所配溶液浓度偏低的是(填选项代号)
| A.NaOH放在纸上称量,且出现潮解现象 |
| B.配制前容量瓶内已有少量蒸馏水 |
| C.定容时仰视 |
| D.NaOH溶液未经冷却就转移到容量瓶中去 |
E.转移溶液时部分溶液溅出容量瓶外
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)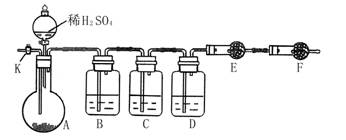
(1)将仪器连接好以后,必须进行的第一步操作是___________________。
(2)此实验还必须用到的最重要的仪器是__________;仪器F的作用是________。
(3)已知仪器C中装有品红溶液,其作用是______________,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是____________________。
(4)实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液d.饱和碳酸氢钠溶液 e.氢氧化钠溶液 f.无水硫酸铜 g.碱石灰 h.五氧化二磷 i.无水氯化钙
①请将下列容器中应盛放的试剂序号填入相应空格:
B中_____________,D中______________,E中_____________。
②实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是______________。所通空气应先经过___________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值_________(填“偏高”、“偏低”或“没影响”)。
(5)若仪器E在试验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为____。
中学课本中常见的几种气体:①O2②H2③CO2④Cl2⑤H2S ⑥SO2⑦NH3都要求掌握其实验室制法。根据所学知识回答有关问题(填气体编号)
(1)能用启普发生器制备的气体有。
(2)能用浓H2SO4干燥的气体有。
(3)能用碱石灰干燥的气体有。
(4)收集气体的方法常有:排水法、向上排空气法和向下排空气法。如下图,用仪器A、B和橡胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外,不能选用其它试剂)正确的操作步骤是。
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。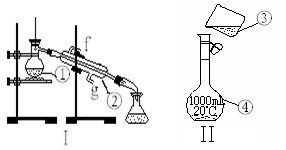
⑴写出下列仪器的名称:
①;②。
⑵仪器①~④中,使用时必须检查是否漏水的有。(填序号)
⑶若利用装置I制取蒸馏水,还缺少的仪器有,将 仪器补充完整后进行的实验操
仪器补充完整后进行的实验操 作的名称为:,冷却水从口进。
作的名称为:,冷却水从口进。
(4)现需配制250 mL 0.2 mol·L—1 NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是, 。
。