请回答氯碱的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果)。
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO2-4等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是 (填序号)。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子腊都只允许阳离子通过。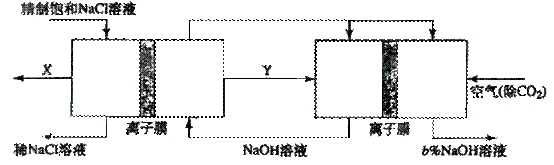
①图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
②分别写出燃料电池B中正极、负极上发生的电极反应
正极:_____________; 负极:_______________;
这样设计的主要节(电)能之处在于(写出2处)____________、____________。
(Ⅰ)下列操作会导致实验结果偏高的是 。
A.配制一定物质的量浓度的硫酸溶液时,定容摇匀后,发现液面低于刻度线
B.在配制一定物质的量浓度溶液时,用10 mL的量筒量取5.0 mL液体溶质时俯视读数
C.用天平称量20.5 g某物质,砝码和药品的位置放反,所得药品的质量
D.配制一定物质的量浓度的溶液时,定容时俯视读数,所得溶液的浓度
(Ⅱ)现有下列仪器或用品:
a铁架台(含铁圈、铁夹);
b锥形瓶;
c滴定管;
d烧杯(若干);
e玻璃棒;
f胶头滴管;
g托盘天平(含砝码);
h滤纸;
i量筒;
j漏斗;
k温度计
现有下列试剂:
A.NaOH固体B.碳酸钠溶液
C.氯化镁溶液 D.蒸馏水
试填空:
(1)如图分别是温度计、量筒、滴定管的一部分,下述判断及读数(虚线刻度)不正确的是 。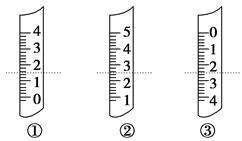
A.①是量筒,读数为1.5 mL
B.②是量筒,读数为2.50 mL
C.③是滴定管,读数为2.50 mL
D.①是温度计,读数是1.50 ℃
(2)配制100 mL 0.1 mol·L-1的氢氧化钠溶液时,还缺少的仪器有 。
(3)除去Mg(OH)2中混有的少量Ca(OH)2,可以用到的试剂是(选填序号),操作方法是 、 、洗涤。完成上述操作,上述仪器或用品用到的有(从上述仪器或用品中选择,填上相应序号)。
铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作_____剂。
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
__Cr2O72-+__SO32-+__ =__Cr3++__SO42-+ __H2O
=__Cr3++__SO42-+ __H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下: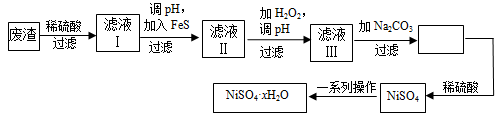
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是____________。
④为测定NiSO4·xH2O晶体中x的值,称取26.3 g晶体加热至完全失去结晶水,剩余固体15.5 g,列式计算x的值等于 。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
【探究一】
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是___________
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用________(选填序号)。
a.KSCN溶液和氯水b.铁粉和KSCN溶液
c.浓氨水d.KMnO4酸性溶液
②乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:[SO2+Br2+2H2O=2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为________。
【探究二】
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。

(3)装置B中试剂的作用是___________________
(4)认为气体Y中还含有Q的理由是________________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于________(选填序号)。
a.A之前 b.A-B间c.B-C间d.C-D间
(6)如果气体Y中含有H2,预计实验现象应是__________
(7)若要测定336mL气体中H2的含量(标准状况下约有28 mL H2),可否用托盘天平称量D或E反应前后的质量差的方法?做出判断并说明理由__________
下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是 (用所学的知识回答)。
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;
② ;
③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br— 的物质的量。
(3)方案一是否可行 (填“是”或“否”),理由是 。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br— )= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3—KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2。
②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。
试通过计算判断:溴与乙醛发生反应的化学方程式为 。
Ⅱ.小刘同学在查阅资料时得知,乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
| 沸点 |
20.8℃ |
117.9℃ |
290℃ |
197.2℃ |
100℃ |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件) 。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在 ;目的是 ;当试管A内的主要反应完成后温度计水银球的位置应在 ,目的是 。
(3)烧杯B内盛装的液体可以是 (写出一种即可,在题给物质中找)。
铜在自然界存在于多种矿石中.
(Ⅰ)以硅孔雀石(主要成分为CuSiO3•2H2O,含少量SiO2、FeCO3、Fe2O3等杂质)为原料制取硫酸铜的工艺流程如下:
已知:Fe3+、Cu2+和Fe2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、6.7和9.7.
(1)“溶浸”中CuSiO3•2H2O和H2SO4发生反应的化学方程式 .
(2)“溶浸”中,选取浓度为20% H2SO4为浸出剂,铜的浸出率与浸出时间的关系见图1.由图1可得,随着浸出时间的增长, (至少写一条变化规律).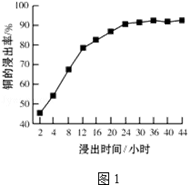
(3)“除杂”中,加入MnO2的作用是 (用离子方程式表示).“除杂”中需在搅拌下加入石灰乳以调节溶液的pH到3~4,沉淀部分杂质离子,分离得滤液.滤渣的主要成分为 .
(Ⅱ)以黄铜矿(主要成分为CuFeS2)为原料炼制精铜的工艺流程如下:
黄铜矿 精铜冰铜(Cu2S和FeS)
精铜冰铜(Cu2S和FeS) 粗铜
粗铜 精铜
精铜
(4)“还原”工艺中其中一个反应为:Cu2S+2Cu2O  6Cu+SO2↑,该反应的氧化剂是 .
6Cu+SO2↑,该反应的氧化剂是 .
(5)粗铜含少量Fe、Ag、Au等金属杂质,电解精炼铜时,阴极反应式为 .完成图2中由粗铜电解得到精铜的示意图,并作相应标注.