有A、B、C、D、E、五种常见的短周期元素,它们的原子序数依次增大,其中C元素原子最外层电子数是次外层电子数的3倍,B元素原子的最外层电子数比C元素原子的最外层电子数少1个;A和D,C和E同主族,又知C、E两原子序数之和是A、D两原子序数之和的2倍。请回答下列问题:
⑴、写出由A、C、D三种元素形成的化合物的的电子式为 ▲ ,该化合物的化学键类型为 ▲ ,晶体类型为 ▲ 。
⑵、B的氢化物的沸点比同主族其他氢化物的沸点高,这可用 ▲ 来解释。
A.极性分子 B.氢键 C.共价键 D.离子键
⑶、D2E溶液呈 ▲ (填“碱性”、“酸性”、“中性”),试用离子方程式解释原因 ▲ 。
⑷、0.5L 0.1 mol/L D的最高价氧化物的水化物与0.25L0.1 mol/LE的最高价氧化物的水化物反应放出2865 J的热量,该反应的热化学方程式为 ▲ 。
⑸、由B的氢化物与C的单质、KOH溶液构成原电池,负极产生B的单质。则其负极的电极反应离子方程式为 ▲ 。
白玉的化学式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、si、H的氧化物表示、。
(1)取8.10g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为g/mol。
(2)另取4.05g白玉粉末加入lmol/L的盐酸100mL中充分溶解,得不溶物2.40g。过滤,将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(STP)。则①p= ;②白玉的化学式为。
;②白玉的化学式为。
2005年的诺贝尔化学奖颁给在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解是指在催化条件下实现C=C双键断裂两边基团换位的反应。
如图表示两个丙烯分子进行烯烃复分解,生成两个新的烯烃分子:2一丁烯和乙烯。
现以丙烯为原料,可以分别合成重要的化工原料I和G,I和G在不同条件下反应可生成多种化工产品,如环酯J;
(1)反应①的类型:反应;反应⑥的类型:反应
(2)G的结构简式:;反应⑩的反应条件:
(3)反应②的化学方程式是;
(4)反应④中C与HCl气体在一定条件只发生加成反应,反应④ 和⑤不能调换的原因是,E的结构简式:;
和⑤不能调换的原因是,E的结构简式:;
(5)反应⑨的化学方程式:。
化学式为C8H10O的化合物A具有如下性质:
①A+Na→慢慢产生气泡
②A十RCOO 有香味的产物
有香味的产物
③A 苯甲酸
苯甲酸
④其催化脱氢产物不能发生银镜反应
⑤脱水反应的产物,经聚合反应中可制得一种塑料制品(它是目前主要的“白色污染”源之一。)
试回答:
(1)根据上述信息,对该化合物的结构可作出的判断是(多选扣分)
| A.苯环上直接连有羟基 |
| B.肯定有醇羟基 |
| C.苯环侧链末端有甲基 |
| D.肯定是芳香烃 |
(2)化合物A的结构简式。
(3)A和金属钠反应的化学方程式。
(4)A的脱水反应化学方程式。
某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
请根据题目要求回答下列问题:
(1)A的化学式为,上述操作过程中用到的玻璃仪器有:①烧杯、②③玻璃棒、③酒精灯、④温度计、⑤。
(2)趁热过滤的目的是。
(3)结晶操作过程中应控制滤液酸性的原因是____
(4)已知硫酸亚铁铵[(NH4)2Fe (SO4)2]比硫酸亚铁稳定,用在分析化学中。硫酸亚铁铵可用硫酸铵和硫酸亚铁反应制得。实验室利用硫酸亚铁铵溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出硫酸亚铁铵溶液与草酸溶液反应的离子方程式____。
(5)草酸亚铁晶体(相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。
①该装置中最不合理的部分(填字母),原因是。
②改用正确装置实验开始后,B处变蓝,说明草酸亚 铁晶体中有;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生(填化学式)。
铁晶体中有;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生(填化学式)。
某中学化学实验小组为了证明和比较SO2和氯水的漂 白性,设计了如下装置:
白性,设计了如下装置: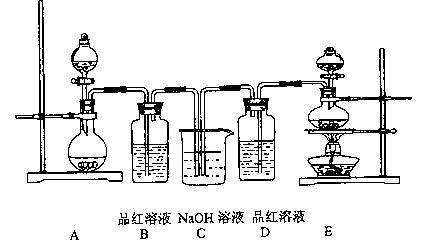
(1)实验室常用装置E制各Cl2,指出该反应中浓盐酸所表现出的性质
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D两个容器加热,两个容器中的现象分别为:BD
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验: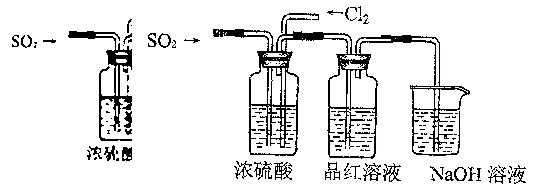
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是
品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是:。(文字结合离子方程式进行说明)
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?。