用右图所示装置进行中和热测定实验,请回答下列问题:
⑴、大小烧杯之间填满碎泡沫塑料的作用是 ▲ ,从实验装置上看,图中缺少的一种玻璃仪器是 ▲ 。
⑵、使用补全仪器后的装置进行实验,取50mL0.25mol/LH2SO4溶液与 50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的比热容c为 4.18J/ (g·℃),溶液的密度均为1g/cm3。通过计算可得中和热
△H= ▲ , H2SO4与NaOH反应的热化学方程式 ▲ 。
⑶、实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 ▲ (填“相等”、“不相等”),所求中和热 ▲ (填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会 ▲ 。(填“偏大”、“偏小”、“不受影响”)
⑷、若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH 1,则ΔH1与ΔH的关系为:ΔH 1 ▲ ΔH(填“<”、“>”或“=”),理由是 ▲ 。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下: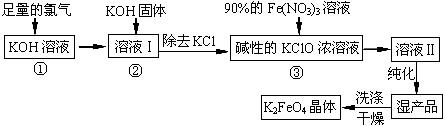
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式 ,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
| A.与反应液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为 KClO |
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:
FeO42¯ + H2O = Fe(OH)3(胶体) + O2↑ +
完成并配平上述反应的离子方程式。
完成以下化学方程式
(1)____S+____KOH===____K2S+____K2SO3+____H2O
(2) KMnO4 + HBr= Br2 + MnBr2 + KBr + H2O
完成下列反应的反应方程式:
(1)NaOH溶液吸收氯气的反应:____________________________
(2)铁与水蒸气在高温下的反应: ____________________________
(3)氢氧化铁溶于盐酸:____________________________
(4)铝单质溶解在氢氧化钠溶液中:____________________________
(5)过氧化钠与二氧化碳反应:____________________________
下表为元素周期表的一部分,其中编号代表对应的元素。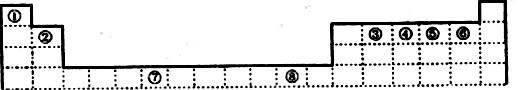
请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的电子排布图为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素③④⑤⑥的第一电离能由大到小的顺序是 (用元素符号表示)。请写出由④和⑤两种元素形成的与N3ˉ互为等电子体的分子的化学式 ,(写出一种即可)其VSEPR构型为 。
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中, 的配位数为 。
的配位数为 。
(5)铜能与类卤素(SCN)2分子(与氯气分子性质相似)反应生成Cu(SCN)2,1m ol(SCN)2分子中含有共价键的数目为 。
铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为 (用含“a、NA的代数式表示)g· 。
。
合成氨是最重要的化工生产。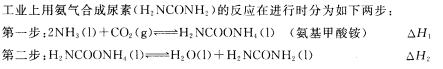
(1)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示: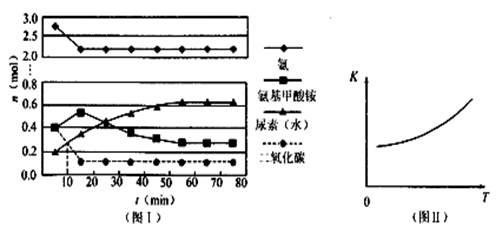
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 决定。
(2)合成氨反应N2(g)+3H2(g)=2NH3(g),使用催化剂反应的△H (填“增大”“减小”或“不改变”
(3)合成氨盐也是氨的重要用途,测定其中的含氮量可以采用“甲醛法”。即
 现有一种纯净的铵盐,可能是硝酸铵、硫酸铵或碳酸铵中的一种。称取2克该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100 mL,浴液,取出10mL,滴人酚酞后再逐滴滴入
现有一种纯净的铵盐,可能是硝酸铵、硫酸铵或碳酸铵中的一种。称取2克该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100 mL,浴液,取出10mL,滴人酚酞后再逐滴滴入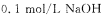 溶液,当滴到25 mL时溶液呈粉红色,且在半分钟内不褪色,则该铵盐中氮的质量分数是 。
溶液,当滴到25 mL时溶液呈粉红色,且在半分钟内不褪色,则该铵盐中氮的质量分数是 。
(4 )拆开 1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,写出N2+3H2 2NH3反应的热化学方程式 ,
2NH3反应的热化学方程式 ,