对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法
①碱洗的目的是洗去铝材表面的自然氧化膜,碱洗时常有气泡冒出,其原因是 (用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c. NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极的电极反应式为 。电解后的铝材需氨洗的目的是 。阳极氧化膜中有微孔,需进行封孔,封孔的操作方法是 。
2.镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是 。
3.利用下图装置,可以模拟铁的电化学防护。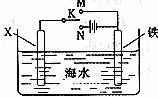
若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。
若X为锌,开关K置于M处,该电化学防护法称为 。
(每空2分,共10分)
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH溶液,其
正极反应为____________________________,
负极反应为__________________________________________;
(2)若电解质溶液为H2SO4,其正极反应为________________,负极反应为____________;若反应过程中转移了2mol电子,可产生水的质量为_________g。
(每空2分,共12分)
(Ⅰ)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,其负极是,负极反应式为;正极是,正极反应式为。受空气的影响还会发生相应的颜色变化,其相应的化学方程式为。
(Ⅱ)下列各情况,在其中Fe片腐蚀由快到慢的顺序是(用序号表示)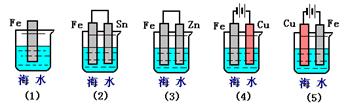
每空2分,共12分)化学反应可为人类提供能量
(Ⅰ)家用液化气的主要成分之一是丁烷(C4H10),常温常压下,当5.8 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2.9×105kJ,试写出丁烷燃烧的热化学方程式:____________________________________________,已知1mol液态水气化时需要吸收44 kJ的热量,则反应: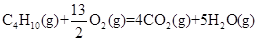 的ΔH为____________________。
的ΔH为____________________。
(Ⅱ)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据上述情况判断:
(1)蓄电池的负极是______,其电极反应式为______________________________。
(2)蓄电池的正极电极反应式为_________________________________。
(3)蓄电池工作时,其中电解质溶液的pH______(填“增大”、“减小”或“不变”)。
A、B、C、D四种物质中均含有氯元素。
①室温下单质A与某种常见一元强碱溶液反应,可得到B和C。B的焰色反应为黄色,C是84消毒液的有效成分。
②化合物D受热催化分解,可制得一种气体,该气体能使带火星的木条复燃。
(1)写出A、B、C、D的名称:
A、_______________B、_______________C、_______________D、_______________
(2)写出①中的化学反应方程式:_______________________________
(3)写出②中的化学反应方程式:_______________________________
(4分)请用方程式写出过氧化钠应用于呼吸面具的原理:
_______________________________________________________