(每空2分,共12分)
(Ⅰ)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,其负极是 ,负极反应式为 ;正极是 ,正极反应式为 。受空气的影响还会发生相应的颜色变化,其相应的化学方程式为 。
(Ⅱ)下列各情况,在其中Fe片腐蚀由快到慢的顺序是(用序号表示) 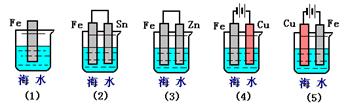
实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应式如下: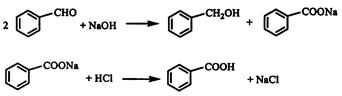
已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)。
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸。
③石蜡油沸点高 于250℃
于250℃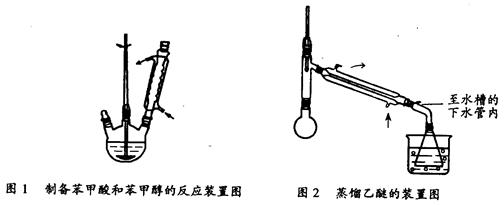
实验步骤如下:
① 向图l 所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20 mL,摇动均匀,冷却至室温。反应物冷却至室温后,用乙醚萃取三次,每次10 mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10 mL水洗涤,分液水层弃去所得醚层进行实验③。
③将分出的醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2 所示蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必需改变加热方式,升温至140℃时应对水冷凝管冷凝方法调整,继续升高温度并收集203℃~205℃的馏分得产品A。
④实验步骤②中保留待用水层慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需(仪器名称),实验前对该仪器进行检漏操作,方法是________________________________。
(2)饱和亚硫酸氢钠溶液洗涤是为了除去,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生原因___________________________。
(3)步骤③中无水硫酸镁是剂;产品A为
(4)蒸馏除乙醚的过程中采用的加热方式为;蒸馏得产品A加热方式是_______________;蒸馏温度高于140℃时应改用_________________冷凝。
(5)提纯产品B 所用到的实验操作为。
CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2 (g) ===CO2(g) △H1= —393.5kJ·mol-1
2H2(g)+O2(g)===2H2O(g) △H2= —483.6kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g) △H3= +131.3kJ·mol-1
则反应CO(g)+H2(g)+O2(g)===H2O(g)+CO2(g)的△H=kJ·mol-1。
标准状况下的煤炭气(CO、H2)33.6L与氧气反应生成CO2和H2O,反应过程中转移______mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为;
则该电池的正极反应式是。
(3)密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。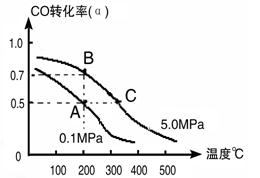
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=;此时在B点时容器的体积VB10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是。
平达喜是一种常用抗酸药,其主要成分是由短周期元素组成的化合物X,式量为602。甲同学欲探究X的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、碱式碳酸镁铝(或结晶水合物)。②Al3+在pH=5.0时沉淀完全; Mg2+在p H=8.8时开始沉淀,在pH=11.4时沉淀完全。
H=8.8时开始沉淀,在pH=11.4时沉淀完全。
实验过程:
I.向一定量的X粉末中加入45.0mL的2mol/L盐酸溶液中,恰好完全反应并收集到112mL(标准状况下)的A气体,A气体可使澄清石灰水变浑浊。
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向I中所得的溶液中滴加氨水,调 节pH至5~6,产生白色沉淀B,过滤。
节pH至5~6,产生白色沉淀B,过滤。
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C。沉淀物进行洗涤干燥后重1.74g,
(1)A的电子式是。
(2)由I可确定X中存在两种带负电荷的原子团及个数比
(3)由I判断X一定不含有的元素是。
(4)Ⅲ中生成B的离子方程式是。
(5)Ⅳ中B溶解的化学方程式是。
(6)沉淀C的化学式是。
(7)若X中n(B)∶n(C)=1∶3,则X的化学式是。
(I)多项选择题
化学与科学、技术、社会、环境密切相关,下列做法中正确的是__________。
| A.研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放 |
| B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
C.为了有效的发展清洁能源,采用电解水的方法大 量制备H2 量制备H2 |
| D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
E.利用化学反应原理,设计和制造新的药物
(II)
浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,下图是海水加工的示意图,根据下图回答问题。
(1)海水淡化工厂通常采用的制备淡水的方法有(写出两种)。
(2)下图是从浓缩海水中提取溴 的流程图。写出下图中①②的化学式:①,②,吸收塔中发生的化学反应方程式为。
的流程图。写出下图中①②的化学式:①,②,吸收塔中发生的化学反应方程式为。
(3)制备金属镁是通过电解熔融的MgC12,而不用MgO,其原因是。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是。
(5)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:3 SiCl4(g)+2 H2(g)+Si(g) 4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的
4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的 质量为kg。
质量为kg。
(I)多项选择题
下列说法中正确的是。
| A.丙烯分子中有8个σ键,1个π键 |
| B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 |
| C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力 |
| D.NCl3和BC13分子中,中心原子都采用sp3杂化 |
E.在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键
(II)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是,其中Ti4+的氧配位数为,Ba2+的氧配位数为,
(3)常温下的TiCl4是有刺激性臭味的无 色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是化合物,其固体是晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有生成。
色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是化合物,其固体是晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有种同分异构体,请在下图方框中将其画出。