氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为__________。
(2)混合①中使用冰水的目的是_______________。
(3)操作Ⅱ和操作Ⅲ的名称分别是_________、________。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为_____________,若假设成立可观察到的现象为__________________。
乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为_____________。
[实验化学]邻叔丁基对苯二酚(TBHQ) 是一种新颖的食品抗氧剂,其制备原理为: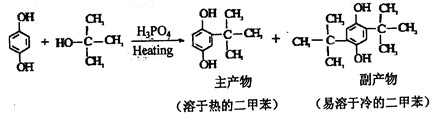
实验过程中的主要步骤如下:
步骤1.向三口烧瓶中加入5.5g对苯二酚,5.OmL浓磷酸及20mL二甲苯(装置如图所示),启动搅拌器。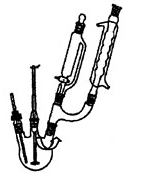
步骤2.缓缓加热到100-110°C,慢慢滴加7.5mL叔丁醇和5mL二甲苯组成的溶液,30-60min内滴完。
步骤3.升温到135-140°C,恒温回流2.5h。
步骤4.将反应液冷却到120°C,直到反应完成
步骤5.将反应液倒入烧杯,并用热水洗涤三口烧瓶,洗液并入烧杯中。
步骤6.冷却结晶,抽滤,回收滤液中的二甲苯和磷酸
步骤7.用二甲苯重结晶、脱色、冷水洗涤、干燥
(1)磷酸在实验中的作用是_____。
(2)本实验中二甲苯的作用是_____。
(3)步骤4中反应完成的标志是_____。
(4)步骤7脱色时,可用的脱色剂是_____。
(5)对合成得到的产品表征,还需要的主要现代分析仪器是_____、_____。
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| K2CO3 |
KHCO3 |
K2SO4 |
KMnO4 |
|
| 溶解度/g |
111 |
33.7 |
11.1 |
6.34 |
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 (填字母)。
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是 ;不宜用盐酸的原因是 。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g 左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为 。
②达到滴定终点的标志为 。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 (填“偏高”、“偏低”或“无影响”)。
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为 。
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3
设计制备装置如下(夹持装置略去):
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为 。
(2)如果没有B装置,C中发生的副反应有 。
(3)甲同学检查完装置气密性良好后进行实验,发现NaNO2的纯度较低。乙同学对上述装置进行适当改进后提高了NaNO2的纯度,其改进措施是 。
(4)丙同学对B中的药品进行了更换,也提高了NaNO2的纯度。丙更换的药品最好是 。
【实验Ⅱ】测定甲、乙同学制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:
| 试管编号 |
① |
② |
③ |
④ |
⑤ |
| NaNO2含量/mg·L—1 |
0 |
20 |
40 |
60 |
80 |
b.分别称量0.10 g甲、乙制得的样品溶于水配成500 mL溶液,贴上标签甲、乙。再分别取5 mL甲、乙待测液,各加入1 mL M溶液,均加蒸馏水至10 mL振荡,分别与标准色阶比较。
(5)步骤b中比较结果是:甲待测液颜色与③号色阶相同,乙待测液颜色与④号色阶相同。则甲同学制得的样品中NaN02的纯度是 %。
(6)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。
| 实验方案 |
实验现象 |
实验结论 |
| 维生素C可以有效降低NaNO2含量 |
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)。
| Fe3+ |
Fe2+ |
Zn2+ |
|
| 开始沉淀的pH |
1.1 |
5.8 |
5.9 |
| 沉淀完全的pH |
3.0 |
8.8 |
8.9 |
请回答下列问题:
(1)由不溶物E生成溶液D的离子方程式为______________________________。
(2)加入ZnO调节pH=a的目的是___________________,a的范围是 。
(3)检验滤液D中不存在铁离子的实验操作是 。
(4)由溶液D制胆矾晶体包含的主要操作步骤是 。
(5)下列试剂可作为Y试剂的是______。
A.ZnOB.NaOH C.Na2CO3D.ZnSO4
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2,I2+2S2O32-=2I-+S4O62-。
①胆矾晶体的纯度为_________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会________(填“偏高”、“偏低”或“不变”)。
[实验化学]苯甲酸广泛应用于制药和化工行业。某化学小组用甲苯作主要原料制备苯甲酸,反应过程如下: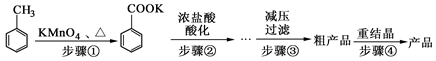
甲苯、苯甲酸钾、苯甲酸的部分物理性质见下表:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
在水中溶解性 |
| 甲苯 |
-95 |
110.6 |
0.8669 |
难溶 |
| 苯甲酸钾 |
121.5~123.5 |
 |
 |
易溶 |
| 苯甲酸 |
122.4 |
248 |
1.2659 |
微溶 |
(1)将步骤①得到混合物加少量水,分离有机相和水相。有机相在 (填“上”或“下”)层;实验操作的名称是 。
(2)步骤②用浓盐酸酸化的目的是 。
(3)减压过滤装置所包含的仪器除减压系统外,还有 、 (填仪器名称)。
(4)已知温度越低苯甲酸的溶解度越小,但为了得到更多的苯甲酸晶体,重结晶时并非温度越低越好,理由是 。
(5)重结晶时需要趁热过滤,目的是 。