(共12分)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”)
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”“无影响”) 。
(6)写出NaOH溶液和盐酸反应表示中和热的热化学方程式 。
(1)甲同学在用FeSO4固体配制FeSO4溶液时,除了加入蒸馏水外,还需加和试剂(填化学式)
(2)乙同学为标定某醋酸溶液的准确浓度,用0.2000 mol·L—1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为。(保留小数点后四位)
(3)丙同学利用:5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O反应,用KMnO4溶液滴定某样品进行铁元素含量的测定。
①设计的下列滴定方式,最合理的是_____。(夹持部分略去)(填字母序号)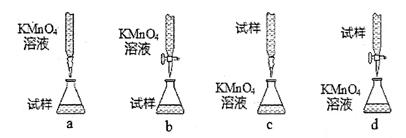
②判断滴定终点的依据是。
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
另称取铁钉6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
(2)甲同学认为X中除Fe3+外还可能含有Fe2+,若要确认其中的Fe2+,可选用(选填序号)。
a.KSCN溶液和氯水b.K3Fe(CN)6溶液c.浓氨水d.酸性KMnO4溶液
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐
溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所
示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石
墨和铁。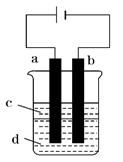
(1)a电极材料为,其电极反应式为。
(2)若电解液d是(填字母编号,下同),则白色沉淀在电极上生成;若是,则白色沉淀在两极之间的溶液中生成。
| A.纯水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
(3)液体c为苯,其作用是,在加入苯之前,要对d溶液进行(填操作名称)处理,其目的是除去溶液中溶解的氧气。
(4)若装置中生成的气体在标准状况下的体积为2.24L,则生成的沉淀质量为g。
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: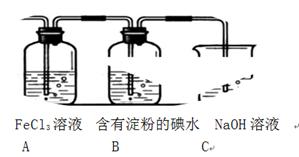
(1)SO2气体还原Fe3+的产物是(填离子符号),参加反应的SO2和Fe3+的物质的量之比是。
(2)下列实验方案适用于在实验室制取所需SO2的是(填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧D.硫铁矿在高温下与O2反应
(3)装置C的作用是。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有(填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是,原因是。
(6)能表明I-的还原性弱于SO2的现象是。
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。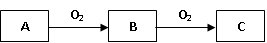
(1)若A是一种黄色单质固体,则B→C的化学方程式为。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为,C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用,请用化学方程式表示该反应原理。
(3)若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体,且B和C易在空气形成光化学烟雾。
①则A为,C为,(填写化学式)
实验室用熟石灰与氯化铵固体共热制取A,写出此化学方程式:。
②写出C与水反应的化学方程式:。