(1)甲同学在用FeSO4固体配制FeSO4溶液时,除了加入蒸馏水外,还需加 和 试剂(填化学式)
(2)乙同学为标定某醋酸溶液的准确浓度,用0.2000 mol·L—1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为 。(保留小数点后四位)
(3)丙同学利用:5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O反应,用KMnO4溶液滴定某样品进行铁元素含量的测定。
①设计的下列滴定方式,最合理的是_____。(夹持部分略去)(填字母序号)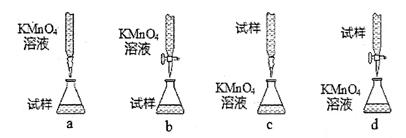
②判断滴定终点的依据是 。
“碘钟”实验中,3I-+S2O42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
| ① |
② |
④ |
⑤ |
⑥ |
|
| c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(S2O42-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t /s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:(1)该实验的目的是。
(2)显色时间t2=。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为(填字母)
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析上表数据,得出的结论是
中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器有:____________________,在大小烧杯之间填满碎泡沫(或纸条)其作用是____________________。
(2)该实验可用0.60 mol·L-1 HCl和0.65 mol·L-1的NaOH溶液各50 mL。NaOH的浓度大于HCl的浓度作用是_____。当室温低于10℃时进行,对实验结果会造成较大的误差其原因是_________。
(3)若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C=4.18 J/(g·℃),则该中和反应放出热量为_____________kJ(填表达式),ΔH="___________" kJ/mol(填表达式)。
(8分) 实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: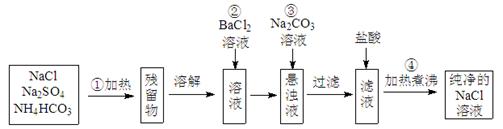
如果此方案正确,那么:
(1)操作①中碳酸氢铵受热(100℃以上)可分解生成氨气、水和二氧化碳的混合气,该混合气的平均摩尔质量为。(数值保留到小数点后一位)
(2)操作②为什么不能改为加硝酸钡溶液?__________________________________。
(3)操作③的目的是__________________________________(结合化学方程式回答)。
(4)操作④的目的是____________________________________________________。
用质量分数为98%、密度为1.84g·cm-3的浓硫酸配制100mL1.84mol·L-1的稀硫酸,若实验仪器有:A.100mL量筒;B.托盘天平;C.玻璃棒;D.50mL容量瓶;E.10mL量筒,F.胶头滴管;G.50mL烧杯;H.100mL容量瓶,
a.实验时应选用仪器的先后顺序是(填入编号):。
b.在容量瓶的使用方法中,下列操作不正确的是(填编号)________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2~3cm处,用滴管加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后,直接倒入容量瓶中,缓慢加入蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
F.往容量瓶中转移溶液时应用玻璃棒引流
c.在配制溶液时,下列操作出现的后果是(填:“偏低”、“偏高”、“无影响”):
(1)配制硫酸溶液时,容量瓶中有少量水。 ______________。
(2)未洗涤烧杯和玻璃棒。__________。
(3)配制好溶液、摇匀后,容量瓶未塞好,洒出一些溶液。_____________。
(4)定容时,俯视读数。________________。
(5)定容时,液面上方与刻度相齐时,停止加水。________________。
(6)定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。____________。
(共6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据: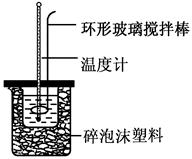
| 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
| 盐酸 |
NaOH溶液 |
||
| 1 |
20.2 |
20.3 |
23.7 |
| 2 |
20.3 |
20.5 |
23.8 |
| 3 |
21.5 |
21.6 |
24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是。
(2)在操作正确的前提下,提高中和热测定准确性的关键是。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH=[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将(填“偏大”、“偏小”、 “不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大