由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐
溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所
示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石
墨和铁。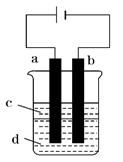
(1)a电极材料为 ,其电极反应式为 。
(2)若电解液d是 (填字母编号,下同),则白色沉淀在电极上生成;若是 ,则白色沉淀在两极之间的溶液中生成。
| A.纯水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
(3)液体c为苯,其作用是 ,在加入苯之前,要对d溶液进行 (填操作名称)处理,其目的是除去溶液中溶解的氧气。
(4)若装置中生成的气体在标准状况下的体积为2.24L,则生成的沉淀质量为 g。
苯甲酸甲酯是一种重要的工业原料,有机化学中通过酯化反应原理,可以进行苯甲酸甲酯的合成。有关物质的物理性质、实验装置如下所示:
| 苯甲酸 |
甲醇 |
苯甲酸甲酯 |
|
| 熔点/℃ |
122.4 |
-97 |
-12.3 |
| 沸点/℃ |
249 |
64.3 |
199.6 |
| 密度/g.cm-3 |
1.2659 |
0.792 |
1.0888 |
| 水溶性 |
微溶 |
互溶 |
不溶 |
实验一:制取苯甲酸甲酯
在大试管中加入15g苯甲酸和一定量的甲醇,边振荡边缓慢加入一定量浓硫酸,按图A连接仪器并实验。
(1)苯甲酸与甲醇反应的化学方程式为_______________ _________。
(2)大试管Ⅰ中除了装有15g苯甲酸和一定量的甲醇和一定量浓硫酸外还需要加入
。
(3)中学实验室中制取乙酸乙酯时为了提高酯的产率可以采取的措施有
__________________ ________。
实验二:提纯苯甲酸甲酯
该实验要先利用图B装置把图A中制备的苯甲酸甲酯水洗提纯,再利用图C装置进行蒸馏提纯
(4)用图B装置进行水洗提纯时,B装置中固体Na2CO3作用是。
(5)用图C装置进行蒸馏提纯时,当温度计显示______时,可用锥形瓶收集苯甲酸甲酯。
实验三:探究浓硫酸在合成苯甲酸甲酯中的作用
(6)比较有、无浓硫酸存在条件下酯化反应进行的快慢,在其他实验条件相同时需要测量的实验数据是。
1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于醇、醚,熔点5.5 ℃,沸点267.4 ℃。1-乙氧基萘常用作香料,也可作为合成其他香料的原料。实验室制备1-乙氧基萘的过程如下:
(1)将混合液置于如图所示的容器中加热充分反应。实验中使用过
量乙醇的原因是。烧瓶上连接长直玻璃管的主要
作用是。
(2)反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏②水洗并分液③用10%的NaOH溶液碱洗并分液④用无水氯化钙干燥并过滤。正确的顺序是。
A.③②④①B.①②③④ C.②①③④
(3)蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、
锥形瓶外还有,。
(4)实验测得1-乙氧基萘的产量与反应时间、温度的变化
如图所示,时间延长、温度升高1-乙氧基萘的产量下
降的原因可能是、。
(5)用金属钠可检验1-乙氧基萘是否纯净,简述实验现象与结论:。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度的位置;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度或"0"刻度以下的某一位置。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至溶液刚好变色,测得盐酸的体积为V1mL。
④重复以上过程两次,测得所耗盐酸的体积分别为V2mL、V3mL。
试回答下列问题:
(1)锥形瓶中的溶液从色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是由此造成的测定结果(偏高、偏低或无影响)
(4)步骤②缺少的操作是由此造成的测定结果(偏高、偏低或无影响)
(5)下图,是某次滴定时的滴定管中的液面,其读数为mL
(6)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.00 |
20.30 |
| 第二次 |
25.00 |
0.00 |
20.20 |
| 第三次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度:mol/L(保留到小数点后4位)。
(14分)用图示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75OC)。已知:PCl3和PCl5遇水强烈反应,它们熔沸点数据如下:
请根据图中装置回答下列问题:
(1)检查该 装置气密性的方法是
装置气密性的方法是
(2)为得到氯气,若B中加入MnO2,则A中应加入,发生反应的化学方程式为。
(3)若发现C中气泡产生过猛,需要进行的操作的关键是。
(4)在反应开始时主要生成PCl3,而后来主要生成PCl5,原因可能是;
从PCl3和PCl5的混合物中分离出PCl3的最佳方法是(选填序号)。
a、蒸馏 b、分液 c、升华
(5)生成的PCl3在G中收集,则F中 盛有, 作用是
盛有, 作用是
(6)C、D、H所盛的试剂分别是:C;D;H 。
(7)如果E中反应放热较多,G处的导管可能发生堵塞,其原因是。
为测定乙炔的相对分子质量,某小组利用下图所示装置进行试验(夹持仪器已略去,气密性已检验)。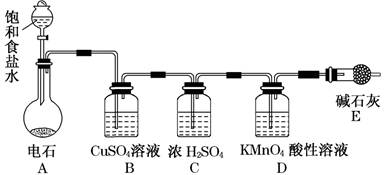
(1)小组查阅资料得出:乙炔能与硫酸酸化的KMnO4反应生成Mn2+和CO2,该反应的化学方程式是。
(2)在装置A中使用饱和食盐水而不直接滴加水的原因。
(3)B中的CuSO4溶液用于除去乙炔中混有的H2S、PH3、AsH3等气体,CuSO4溶液除H2S气体的反应类型是(基本反应)。
(4)实验前D中含有x mol KMnO4的酸性溶液,实验时向D中通入一定量的乙炔直至KMnO4酸性溶液恰好完全褪色,实验完毕后装置D及E的总质量共增重y g,通过计算求出所测乙炔的相对分子质量(用含字母x、y的代数式表示):__________(不写计算过程)。
(5)若该小组的实验原理及所有操作都正确,下列因素中,对所测乙炔相对分子质量的值不会产生影响的是________。
A.将装置A中产生的混合气体直接通入D中的KMnO4酸性溶液
B.将E装置(盛有碱石灰的干燥管)换成盛有浓硫酸的洗气瓶
C.通入过量纯净的乙炔气体于KMnO4酸性溶液时,有部分乙炔未被氧化而逸出
(6)另一活动小组的同学认为上述实验装置仍存在不足,则改进的措施是______________。