某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示: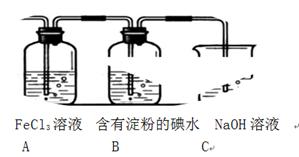
(1)SO2气体还原Fe3+的产物是 (填离子符号),参加反应的SO2和Fe3+的物质的量之比是 。
(2)下列实验方案适用于在实验室制取所需SO2的是 (填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.硫铁矿在高温下与O2反应
(3)装置C的作用是 。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I-的还原性弱于SO2的现象是 。
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
现准确称取4.4 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重8.8 g,B管增重3.6g。请回答:
(1)C管中浓硫酸的作用是________________________________________;
(2)按上述所给的测量信息,装置的连接顺序应是:_______________(每种装置只用一次);
(3)要确定该有机物的分子式,还必须知道的数据是_________________;
①C装置增加的质量
②样品的摩尔质量
③CuO固体减少的质量
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式,与该有机物相对分子质量相同的烃的一氯代物有种。
某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
已知:
| 密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
61 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |

(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在______层(填上或下),分液后用______(填入编号)洗涤.
a.KMnO4溶液b.稀H2SO4c.Na2CO3溶液
②再将环己烯按图2所示装置蒸馏,冷却水从______口进入。蒸馏时要加入生石灰,目的是 .
③收集产品时,控制的温度应在____左右,实验制得的环己烯精品质量低于理论产量,可能的原因是____
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是______.
a.用酸性高锰酸钾溶液 b.用金属钠c.测定沸点.
实验室用浓盐酸和MnO2制取并探究Cl2化学性质,装置图下图所示: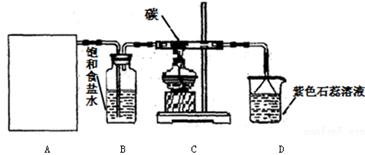
(1)A是氯气发生装置,实验室制取Cl2的原理是(用化学方程式表示)
(2)该实验中A部分的装置是(填字母)
(3)从C装置出来的气体中含有CO2和HCl,则从B装置导出的气体成分是。
(4)D装置的作用是,可能观察到的现象是。
(5)为进行有关氯气的性质实验,需要4瓶容积为122 mL的氯气(室温下,氯气的密度为2.91g/L),理论上需要MnO2的质量是,实际称量的MnO2固体的质量必须适当多余理论量,原因是
(6)若将装置A如图所示进行连接,探究其与某些溶液分反应的性质,回答下列问题。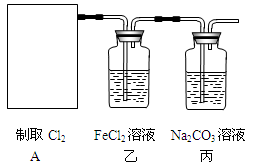
①乙装置中FeCl2溶液与Cl2反应的离子方程式是。证明FeCl2与Cl2发生了氧化还原反应的实验方法是。
②丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。该物质可能是。
| A.Cl2 | B.NaClO | C.Na2CO3 | D.Na2O2 |
根据实验目的按要求填空。(a、b为弹簧夹,加热及固定装置已略去)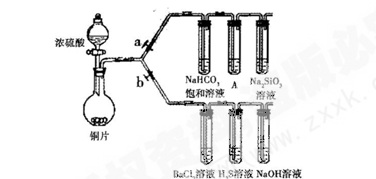
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①实验步骤:连接仪器、________、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式为___________________,装置A中的试剂是________。
③能说明碳的非金属性比硅强的实验现象是:_______。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①实验步骤:打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式为____。
③BaCl2溶液中无沉淀现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
写出其中SO2 显示还原性并生成沉淀的离子方程式_________。
孔雀石主要成分是Cu2(OH)2CO3,还含少量难溶的FeCO3及Si的化合物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下: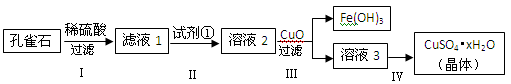
(1)步骤Ⅰ中涉及的反应用离子方程式表示为_____________________________。
(2)为将溶液中Fe2+氧化成Fe3+步骤Ⅱ中加入的试剂①最好是__________(填代号)。
a.KMnO4 b.H2O2 c.Fe粉 d.KSCN
(3)步骤Ⅳ获得硫酸铜晶体,需要经过_________、_________、过滤等操作。
(4)孔雀石与焦炭一起加热可以生成Cu及其它无毒物质,写出该反应的化学方程式_____________。
(5)测定硫酸铜晶体(CuSO4·xH2O)中结晶水的x值:称取2.5g硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为1.6g。则计算得x=______