工业上利用氢气在氯气中燃烧,将所得产物溶于水制备盐酸。有人设想利用原电池原理直接制备盐酸的同时获取电能,假设这种想法可行,下列说法肯定错误的是
| A.两极材料都用金属铂,用一定浓度的盐酸做电解质溶液 |
| B.通入氯气的电极为原电池的正极 |
| C.该方法可将化学能完全转化为电能 |
| D.通氢气的电极发生的反应为:H2 → 2H++2e- |
25℃时,下列溶液中水的电离程度最小的是
| A.pH =" 2" 的CH3COOH溶液 |
| B.0.01 mol/L Na2CO3溶液 |
| C.0.001 mol/L盐酸 |
| D.pH =10氨水 |
不能证明HA是弱酸的是
| A.0.1 mol·L-1 NaA溶液pH=10 |
| B.0.01 mol·L-1 HA溶液的pH=4 |
| C.pH=2的HA溶液稀释100倍后pH=3.5 |
| D.HA溶液跟锌反应,放出H2很慢 |
其他条件不变时,下列说法正确的是
| A.升高温度,活化分子百分数增加,化学反应速率增大 |
| B.增大压强,活化分子百分数增加,化学反应速率增大 |
| C.加入反应物,活化分子百分数增加,化学反应速率增大 |
| D.活化分子间所发生的碰撞均为有效碰撞 |
对于反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列四种不同情况下测得的反应速率,能表明该反应进行得最快的是
4NO(g)+6H2O(g),下列四种不同情况下测得的反应速率,能表明该反应进行得最快的是
| A.v(NH3) =" 0.2" mol·L-1·s-1 |
| B.v(O2) =" 0.24" mol·L-1·s-1 |
| C.v(H2O) =" 0.25" mol·L-1·s-1 |
| D.v(NO) =" 0.15" mol·L-1·s-1 |
一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。下列关于反应的说法错误的是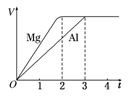
| A.镁和铝的物质的量之比为3∶2 |
| B.镁和铝转移电子数之比为1∶1 |
| C.镁和铝的摩尔质量之比为8∶9 |
| D.镁和铝反应所用时间之比为3∶2 |