某化学研究性学习小组的同学在学习了NH3的性质时讨论:运用类比的思想,既然NH3具有还原性,能否像H2那样还原CuO呢?他们设计实验制取NH3并探究上述问题。请你参与该小组的活动并完成下列研究:
(1)制取NH3
①写出实验制取NH3的化学方程式 ;
②在实验室中,还可以用浓氨水与 (填写一种试剂)快速制取少量NH3;
③有同学模仿排饱和食盐水收集氯气的方法,想用排饱和NH4Cl溶液的方法收集NH3。你认为他能否达到目的? (填“能”或“否”)。
(2)该小组中某同学设计了下图所示的实验装置(夹持未画出),探究NH3的还原性: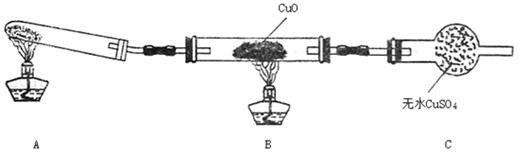
①该装置在设计上有一定缺陷,对该装置的改进措施是:
______________________________________________________________________
____________________________________________________________________。
②利用改进后的装置进行实验,充分反应后,观察到CuO全部变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出NH3与CuO反应的化学方程式 。
(3)问题讨论
有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+ = Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
。
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 |
现象 |
| 取4g漂粉精固体,加入100mL水 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH |
pH试纸先变蓝(约为12),后褪色 |
 |
i.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是________________________;
②由实验a、b不能判断白雾中含有HCl,理由是________________________;
(2)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.通过进一步实验确认了这种可能性,其实验方案是________________________;
(3)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HCl,无明显变化.取上层清液,加入BaCl2溶液,产生白色沉淀.则沉淀X中含有的物质是___________;
②用离子方程式解释现象ⅲ中黄绿色褪去的原因___________。
实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol (CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g.
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数_________(填“偏高”、“偏低”或“无影响”);
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积_________(填“偏高”、“偏低”或“无影响”);
③滴定时边滴边摇动锥形瓶,眼睛应观察_________;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色;
(2)滴定结果如下表所示:
| 滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010mol•L-1,则该样品中氮的质量分数为_________。
用50mL0. 50 mol•L-1盐酸与50mL0. 55mol•L-1NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________;
(2)烧杯间填满碎纸条的作用是________;
(3)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大、偏小、无影响”);
(4)如果用60mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等、不相等”),所求中和热______(填“相等、不相等”),简述理由__________。
Ⅰ.(1)实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。理论上硫酸和硝酸的物质的量之比最佳为:_____________
(2)实验上,即使铜粉、硫酸及硝酸都比较纯,制得的CuSO4·5H2O中还是可能存在杂质,除去这种杂质的实验操作称为___________。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案甲:以空气为氧化剂。将铜粉反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案乙:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加少量FeSO4,即发生反应,生成硫酸铜.反应完全后,加M调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol•L-1,就认为沉淀完全)然后过滤、浓缩、结晶。
请回答下列问题:
①方案甲中,钢丝应在__________中反复灼烧;(填仪器名称)
方案丙:将钢丝放到一定量的稀硫酸中,加入适量的H2O2,并控制温度在50℃~60℃,持续反应1h,也能获得硫酸铜。请回答下列问题:
②反应时温度必须控制在50℃~60℃,温度不宜过高的主要原因是______________________;
Ⅱ.用湿法制磷酸的副产品氟硅酸(H2SiF6)生成无水氟化氢的工艺如下图所示:
已知氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于醇.在热水中水解成氟化钾、氟化氢及硅酸.
(1)写出反应器中的化学方程式:____________________________。
(2)在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤而不是用水,其目的是:_________________。
(3)该流程中哪些物质可以循环使用:____________________________。
(4)为了测定无水氟化氢的纯度,取标况下的气体产物2.24L,测得质量为3.1g,试解释,为什么标况下2.24L产物的质量远远大于2.0g,____________________________。
资料显示:a.Na2S2O3、BaS2O3、BaS均易溶于水。
b.SO2、Na2SO3、Na2CO3反应可生成Na2S2O3。某化学小组据此进行了制备硫代硫酸钠(Na2S2O3)的探究。实验制备装置如图所示(省略夹持装置):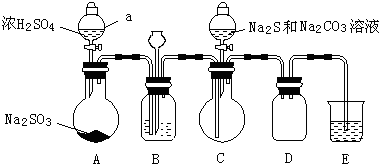
回答问题:
(1)装置A中发生反应的化学方程式是__________________;
(2)装置B的作用之一是观察SO2的生成速率.
①B中最好盛装的液体是____________________;
a.蒸馏水b.饱和Na2SO3溶液 c.饱和NaHSO3溶液d.饱和NaHCO3溶液
②如使SO2缓慢进入烧瓶C,正确的操作是________________;
(3)在装置C中生成Na2S2O3.
①完成反应方程式:___SO2+_____ Na2S+_____Na2CO3=_____Na2S2O3+ _____
②反应开始先使A中发生反应一会儿,再使C中反应发生,其原因是_______________;
(4)完成对所得产品的检测的实验:
| 推测 |
操作和现象 |
结论 |
| 杂质中的正盐成分可能有:Na2S、Na2CO3、Na2SO4 及___________ |
①取Wg产品配成稀溶液; ②向溶液中滴加过量BaCl2溶液, 有白色沉淀生成,过滤,得沉淀和滤液; ③向沉淀中加入过量盐酸,沉淀完全溶解, 并有刺激性气味的气体产生。 |
产品杂质中: 一定含有________ 可能含有________ 一定不含有_________ |