过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用。某学生为了验证这一实验,以足量的大理石、足量的盐酸和过氧化钠样品为原料,制取O2,设计出如下实验装置: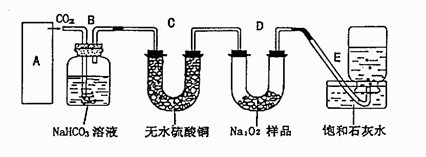
(1)A中制取CO2 的装置,应从下列图①、②、③中选哪个图:
B装置的作用是 ,C装置内可能出现的现象是 。
(2)二氧化碳和过氧化钠反应的化学方程式为 ,
(3)为了检验E中收集到的气体,在取出集气瓶后,如何检测 。
(4)若乙中的石灰水出现出现轻微白色浑浊,请说明原因: 。
(13分) 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去):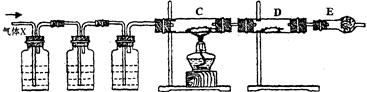
A KMnO4溶液 B
试回答:
(1)上述反应中生成二氧化硫的化学方程式为 ______________;
(2)乙同学认为还可能产生氢气的化学方程式是;
(3)丙同学在安装好装置后,必不可少的一步操作是:;
(4)A中加入的试剂可能是,作用是_____;
B中加入的试剂可能是,作用是 ___________;
E中加入的试剂可能是,作用是 ___________。
(5)可以证明气体X中含有氢气的实验现象是:
C中:_____________________;D中:_____________________________。
(共14分)用18mol/L的浓硫酸配制3mol/L的稀硫酸100mL,按正确的操作顺序,将序号
填入括号内并填写下列空格。
( )用少许蒸馏水洗涤小烧杯,将洗涤液沿_______注入__________并重复2次。
( )将浓硫酸沿烧杯壁慢慢注入盛有少量蒸馏水的小烧杯中,并用玻璃棒不断搅拌。
( )用量筒取浓硫酸______mL。
( )将容量瓶盖紧摇匀。
( )将已冷却的硫酸溶液沿________注入________中。
( )改用胶头滴管加蒸馏水,使溶液凹液面最低处恰好与刻度线相切。
( )继续向容量瓶内小心加蒸馏水,直至接近刻度线__________cm处。
若实验遇到下列情况,对所配溶液中硫酸的物质的量浓度有何影响(填偏高、偏低、无影响)。
(1)用量筒量取浓硫酸时俯视刻度线___________;
(2)稀释过程中不慎有硫酸液滴溅出____________;
(3)未将洗涤液加入容量瓶___________;
(4)定容时仰视刻度线__________;
(5)摇匀后发现凹液面下降,又加蒸馏水至刻度线__________;
(6)配制前容量瓶用水洗涤后未进行干燥处理__________。
某化学兴趣小组欲选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。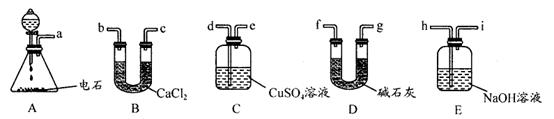
I.(1)A中制取乙炔的化学反应方程式为:。
(2)制乙炔时,旋开分液漏斗活塞,使水缓慢滴下的原因是;
(3)用电石制的乙炔中常含有H2S、PH3等杂质,除去杂质应选用(填序号,下同)装置,
气体应从进;干燥乙炔最好选用装置。(提示:PH3与CuSO4反应可生成Cu3P沉淀)
Ⅱ.为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验: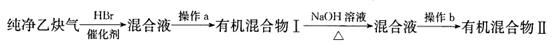
(1)操作b的名称是;
(2)有机混合物I可能含有的物质是(写结构简式)。
(3)最后得到的有机混合物Ⅱ中含两种有机物,其中一种是饱和一元醛,其结构简式为;
已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下: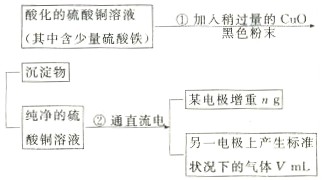
回答下列问题:
(1)加入CuO的作用是。
(2)步骤②中所用的部分仪器如下图所示,则A、B分别连直流电源的和极(填“正”或“负”)。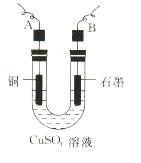
(3)电解开始后,在U形管中可以观察到的现象有:。电解的离子方程式为。
(4)下列实验操作中必要的是(填写字母)。
(A)称量电解前的电极的质量;(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;(C)刮下电解后电极上析出的铜,并清洗,称量;(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为(用带有m、V的计算式表示)。
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先赶出去其中的空气。其中第一步实验操作为。如何确定E中空气已被赶尽。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为。
(3)如何证明E中收集到的是NO而不是H2?。
一段时间后,C中白色沉淀溶解,其原因是。
(4)装置D的作用是。