A、B、M、X、Y、Z是短周期元素,且原子序数依次增大,已知它们的部分化合物的性质如下:
| A的氢化物 |
B的氢化物 |
M的氢化物 |
X的氧化物 |
Y的氢化物分子构型 |
Z的最高价氧化物 |
| 含氢量最高的有机物 |
水溶液呈碱性 |
水溶液呈酸性 |
两性氧化物 |
正四面体 |
对应水化物为最强酸 |
(1)M原子核外电子占据的轨道有________个,B的氢化物的电子式__________。
(2)M、X、Z三种元素简单离子的半径由大到小的顺序____________________(用离子符号和“>”表示)
(3)B的氢化物和Z的氢化物相遇时现象是____________________________。
(4)推测A和Y组成的化合物的熔点____________(填“高”或“低”),理由是________。
(5)A元素的氢化物有多种,1mol A的某种氢化物中含有14 mol电子,已知常温常压下1g该氢化物在足量氧气中充分燃烧生成液态水时放出热量为50 kJ,写出该反应的热化学方程式________________________________________。
合成氨工业的核心反应是: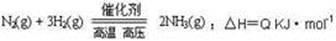
能量变化如右图,回答下列问题:
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”、“减小”、“不变”)
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量 (填“<”、“>”或“=”)46.2kJ;
(3)关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S< 0 C.△H<0,△S>0 D.△H<0,△S<0(4)将一定量的N2(g)和H2(g)放入 1L密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.10mol,H2为0.30mol,NH3为0.10mol。计算该条件下达到平衡时H2转化为NH3的转化率 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中,欲提高合成氨中H2的转化率,下列措施可行的是 (填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨
在80℃时,0.40mol的N2O4气体充入 2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为 。
(2)计算在 80℃时该反应的平衡常数K 。
(3)能判断该反应是否已达化学平衡状态的依据是________________。
a.容器中压强不变
b.混合气体中c(N2O4)不变
c.v正(NO2)=v逆(N2O4)
d.混合气体密度不变
e.混合气体的平均摩尔质量不变
f.c(N2O4)= c(NO2)
(4)反应进行至100s后将反应混合物的温度降低,混合气体的颜色 (填“变浅”、“变深”或“不变”)。
(5)要增大该反应的K值,可采取的措施有(填序号) ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) 。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(6)如右图是 80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在 60℃时N2O4物质的量的变化曲线。
(8分)某白色粉末A常在果园里用作杀菌剂,现进行下列实验:①白色粉末溶解在水中,得到蓝色溶液;②往蓝色溶液中加入适量的盐溶液B,恰好沉淀完全,过滤,得到白色沉淀和蓝色溶液;③往蓝色溶液中加入适量C溶液,恰好沉淀完全,过滤,得到蓝色沉淀和纯净的硝酸钾溶液。
(1)根据实验现象推断 A.,B.,C.。
(2)写出操作②所发生反应的化学方程式:。
氧化还原反应在农业生产中和日常生活中有广泛的运用。
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6),提供能量以维持生命活动,反应的化学方程式为C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有(填“氧化性”或“还原性”)
(3)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收。服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中,维生素C所起的作用是填“氧化作用”和“还原作用”)
(4)全世界每年有近1/10的钢铁因生锈而损失,人们常用稀硫酸除去钢铁表面的铁锈(Fe2O3),请写出除铁锈的离子方程式:,然而这并不能解决根本问题,实质上我们应该怎样防止铁生锈,生活中通常采用方法(符合题意一种即可)防止铁生锈。
现有mg某气体,它由四原子分子构成,它的摩尔质量为Mg·mol-1。则:
(1)该气体的物质的量为__________________mol;
(2)该气体所含原子总数为________________个(用NA表示即可);
(3)该气体在标准状况下的体积为_____________L;
(4)该气体溶于水后形成 V L溶液,其溶液的物质的量浓度为____________ mol·L-1;
(5)该气体溶于a ml 水中(假设该气体与水不反应),所得溶液溶质质量分数为_______。