提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空: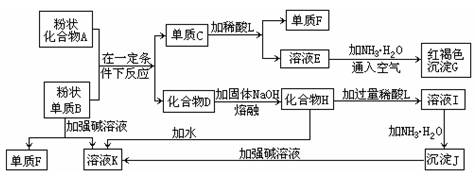
(1)单质F是_____________________。
(2)写出由E生成G的化学反应方程式或离子方程式 ___________________。
(3)溶液I中所含金属离子是_____________________。
(4)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)____________________。
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)五种元素的原子半径从大到小的顺序是 (用元素符号表示)。
(2)X与Z形成的3∶1的化合物A,它与Z的最高价氧化物对应的水化物B反应的化学方程式 ,该水溶液显 性,用离子方程式解释原因 。
(3)硒是人体必需的微量元素,与L同一主族,其最高价氧化物对应的水化物化学式为 。该元素固体单质与H2反应生成0.5 mol气态氢化物时吸收了14.87kJ的热量,请写出1mol该物质与氢气化合的热化学方程式 。
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:  ;由R生成Q的化学方程式: 。
;由R生成Q的化学方程式: 。
请用单线桥表示该氧化还原反应,并指出该反应的还原产物。
2Na2O2 +2CO2 ===2Na2CO3+O2,还原产物是 。
已知A-K是中学化学中常见有机物,其中G不能使酸性高锰酸钾溶液褪色,它们之间有如下关系。
试回答下列问题:
(1)写出实验室制取A的化学方程式:_________________________________________;
(2)写出D→E的化学方程式:________________________________________________;
(3)B在一定条件下可通过加聚合成一种重要的塑料,写出该合成反应的方程式:
_____________________________________ _________________________________;
_________________________________;
(4)(2分)写出化合物F的结构简式:酯K的结构简式:__________________;
(5)请写出F+J→K的化学反应方程式
乙酸苯甲酯对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业。乙酸苯甲酯可以用下面的设计方案合成。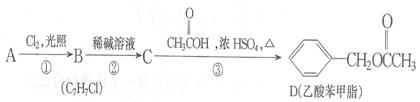
(1)写出A、C的 结构简式:、。
结构简式:、。
(2)D有很多同分异构体,其中属于酯且一取代苯结构的同分异构体有5个,已知其中3个的结构简式是:
请写出另外两个同分异构体的结构简式:、。
今有化合物:
(1)请写出丙中含氧官能团的名称:。
(2)请判别上述哪些化合物互为同分异构体:。
(3)请分别写出鉴别甲、乙、丙化合物的方法。(指明所选试剂及主要现象即可)
鉴别甲的方法:;
鉴别乙的方法:;
鉴别丙的方法:. (4)请按酸性由强至弱排列甲、乙、丙的顺序:。
(4)请按酸性由强至弱排列甲、乙、丙的顺序:。