I.有关中和滴定的操作有: ①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水 ④滴定 ⑤洗涤
正确的操作顺序是 (填字母)
| A.⑤①②③④ | B.③⑤①②④ | C.⑤②③①④ | D.②①③⑤④ |
Ⅱ.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现有0.001mol·L-1KMnO4酸性溶液和未知浓度的无色NaHSO3溶液。反应的离子方程式是:2MnO4-+5HSO3-+H+ = 2Mn2++5SO42-+3H2O
填空回答下列问题:
(1)不用 (填“酸式”或“碱式”)滴定管盛放高锰酸钾溶液。
(2)选何种指示剂 。(填序号)
①甲基橙 ②酚酞 ③ 石蕊 ④不用指示剂
(3)滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面刻度为b mL,则
(b-a)mL比实际消耗KMnO4溶液体积 (填“多”或“少”)。根据(b-a)mL计算得到的待测液浓度,比实际浓度 (填“大”或“小”)。
(4)无论是KMnO4溶液往NaHSO3溶液中滴,还是NaHSO3溶液往KMnO4溶液中滴,在其他操作正确规范的前提下,下列操作一定会使测定结果偏高的是 。(填序号)
①取用NaHSO3溶液的滴定管未用待测NaHSO3溶液润洗
②取用KMnO4酸性溶液的滴定管未用标准KMnO4酸性溶液润洗
③滴定过程中不慎有液体溅出
④滴定前仰视读数,滴定后平视读数
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空:
(1)写出电解饱和食盐水的化学方程式。
(2)如果粗盐中SO 含量较高,必须添加钡试剂除去SO
含量较高,必须添加钡试剂除去SO ,该钡试剂可以是(选填A、B、C,多选扣分)
,该钡试剂可以是(选填A、B、C,多选扣分)
A.Ba(OH)2B.Ba(NO3)2C.BaCl2
(3)判断钡试剂已经过量的方法是。
(4)为有效除去Ca2+、Mg2+、SO ,加入试剂的合理顺序为(选填A,B,C多选扣分)
,加入试剂的合理顺序为(选填A,B,C多选扣分)
A.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
B.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
C.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
(5)为检验精盐纯度,需配制150 mL0.2 mol/LNaCl(精盐)溶液,下图是该同学转移溶液的示意图,
图中的错误是。
关于该配制过程中,下列说法正确的是________。
A.应称取氯化钠晶体的质量为1.755 g
B.洗涤液不需要转移到容量瓶中
C.定容时,由于同学仰视,将导致所配溶液浓度偏低
D.摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切
表示溶液浓度的方法通常有两种:溶液中溶质的质量分数(ω)和物质的量浓度(c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
(1)用10%(密度为1.00g·cm-3)的NaOH溶液配制成27.5g2%的NaOH溶液。
①计算:需______g10%(密度为1.00g·cm-3)的NaOH溶液,需加______mL水(密度为1.00g·cm-3)进行稀释。
②量取:用_______mL量筒(可供选择的量筒规格有:5mL、10mL、25mL、50mL,下同)量取10%的NaOH溶液,量取时视线要跟量筒内液体_______相切,然后倒入烧杯里,用______mL量筒量取蒸馏水注入烧杯里。
(2)把98%(密度为1.84g·cm-3)的浓硫酸稀释成3mol/L的稀硫酸100mL,回答下列问题:
①需要量取浓硫酸___________mL(保留一位小数)。
②配制操作可分解成如下几步,正确的操作顺序是:___________。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
C.把已冷却的稀硫酸注入经检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶的塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使液面达到刻度线
H.继续往容量瓶中加蒸馏水,使液面接近刻度线
③如果上述C操作中把未冷却的稀硫酸注入容量瓶中,所配溶液的浓度将_________ (填“偏高”、“偏低”或“无影响”,下同);如果上述D操作中量取浓硫酸后量筒内滞留的浓硫酸用少量蒸馏水洗涤并将洗涤液转入E操作中的小烧杯中,所配溶液的浓度将_________;如果上述G操作中目光仰视,所配溶液的浓度将_________;如果上述D操作中目光俯视,所配溶液的浓度将_________。
(3)实验室用NaOH固体配制1mol/L的NaOH溶液和用98%(密度为1.84g·cm-3)的浓硫酸配制1mol/L的H2SO4溶液各100mL。
①配制1mol/L的NaOH溶液,在用托盘天平称取NaOH固体时,天平读数为_______(填代号,下同)。
A.4.0gB.小于4.0g C.大于4.0g
②配制1mol/L的H2SO4溶液,在烧杯中稀释浓硫酸的正确操作是:。
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250 mL容量瓶中定容成250 mL烧碱溶液; |
| B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂; |
| C.在天平上准确称取烧碱样品m g,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为c mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1 mL; |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL。
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写) 

 D
D  。
。
(2)操作D中液面应调整到 。
(3)滴定终点的现象是。
(4)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响?(填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(5)该烧碱样品的纯度计算式是。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下(已知2KI+Cl2===2KCl+I2,碘与溴一样易溶于有机溶剂):
(1)指出提取碘的过程中有关的实验操作名称:①________,③________。
(2)提取碘的过程中,可供选择的有机试剂是________。
A.苯 B.四氯化碳 C.酒精
(3)为使上述流程中含碘离子溶液转化为碘的有机溶液,实验室里有烧杯、玻璃棒以及必要的夹持仪器,尚缺少的玻璃仪器是。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出上图所示实验装置中的错误之处:
①。
②。
③。
(5)进行上述蒸馏操作时使用水浴的原因是。
(6)四氯化碳是____色液体。如果本实验用苯做萃取剂,则上层液体的颜色为色,下层液体中溶质的主要成分为___________(写化学式)。
某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究。
【提出假设】:小组同学经过分析讨论认为生成气体可能含H2和SO2。
【设计实验方案,验证假设】主要包括两个环节:
Ⅰ.验证SO2,实验装置如图所示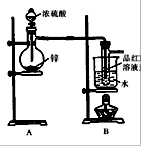
Ⅱ.检验产物中含有H2,实验内容将由B部分导出的气体依次通过装置C、D、E、F、G。Ⅱ中装置C、D、E、F、G的信息如下表所示:
| 仪器标号 |
C |
D |
E |
F |
G |
| 仪器 |
洗气瓶 |
洗气瓶 |
硬质玻璃管,加热 |
干燥管 |
干燥管 |
| 仪器中所加物质 |
NaOH溶液 |
浓硫酸 |
CuO粉末 |
试剂X |
无水CaCl2固体 |
试回答下列问题:
(1)小组同学认为生成气体中含H2的理由是;
(2)盛放锌粒的仪器名称是;
(3)B部分装置的目的是验证SO2并探究SO2与品红作用的可逆性,实验的操作及主要现象是;
(4)①装置D、G的作用依次是、;
②E中发生反应的化学方程式是;
③试剂X是。