A~H等8种物质存在如下转化关系(反应条件,部分产物未标出)。已知:A是酸式盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:
(1)写出下列物质的化学式:A ,B ,C 。
(2)写出下列反应的化学方程式:
E→F ;
G→H ;
H的浓溶液与红热的木炭反应的方程式: 。
B与H2S反应的化学方程式: 。
(3)检验某溶液中是否含A中阳离子的方法是 。
有下列各组微粒或物质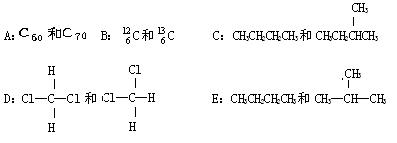
①组两种微粒互为同位素;②组两种物质互为同素异形体;
③组两种物质属于同系物;④组两物质互为同分异构体;
⑤组两物质是同一物质。
(17分)运用化学反应原理研究溶液的组成与性质具有重要意义。请回答下列问题:
(1)用惰性电极电解含有NaHCO3的NaCl溶液,假设电解过程中产生的气体全部逸出,测得溶液pH变化如图所示。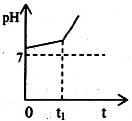
则在0→t1时间内,阳极反应式为,溶液pH升高比较缓慢的原因是(用离子方程式回答)。
(2)含氨废水易引发水体富营养化。向NH4Cl溶液中加入少量NaOH固体,
溶液中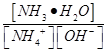 ______________(填“增大”“减小”或“不变);25℃时,NH3·H2O的电离平衡常数Kb=1.8×10—5mol·L—1,该温度下,1 mol·L—1的NH4Cl溶液中c(H+)="________________" mol
______________(填“增大”“减小”或“不变);25℃时,NH3·H2O的电离平衡常数Kb=1.8×10—5mol·L—1,该温度下,1 mol·L—1的NH4Cl溶液中c(H+)="________________" mol L
L 。(已知
。(已知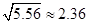 )
)
(3)如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式。
(4)某工业生产中,向含有大量Ca2+、Mn2+的溶液中加入足量NH4HCO3,生成MnCO3沉淀和CO2,写出该反应的离子方程式,剩余溶液中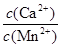 <。
<。
[已知Ksp(MnCO3)=1×10-11(mol·L-1)2,Ksp(CaCO3)="5" ×10-9(mol·L-1)2]
氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、 脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g)△H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g)△H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图所示。
则0~10 min内,氢气的平均反应速率为_______mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡(填“正向”、“逆向”或“不”)移动。
(3)脱硫。利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得。NaOH溶液吸收SO2的过程中,pH随n(SO32-)︰n(HSO3﹣)变化关系如下表:
| n(SO32﹣)︰n(HSO3﹣) |
91︰9 |
1︰1 |
9︰91 |
| pH |
8.2 |
7.2 |
6.2 |
①由上表判断,NaHSO3溶液显性,用化学平衡原理解释:。
②当溶液呈中性时,离子浓度关系正确的是(选填字母):。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+) > c(HSO3-) > c(SO32-) > c(H+) = c(OH-)
c.c(Na+) + c(H+) = c(SO32-) + c(HSO3-) + c(OH-)
(4)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有 生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
铵盐在工农业生产中有着重要的用途,请根据要求完成下列各题。
Ⅰ.某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液。
(1)仪器连接的顺序(用接口序号字母表示)是:a
(2)试从电离平衡角度分析该实验装置A中能产生氨气的原因:。
(3)将装置C中两种液体分离开的操作名称是。
Ⅱ.为提高氯化铵的经济价值,我国化学家设计了利用氢氧化镁热分解氯化铵制氨气并得到碱式氯化镁[Mg(OH)Cl]的工艺。某同学根据该原理设计的实验装置如图:
请回答下列问题:
(1)装置A中发生反应生成碱式氯化镁的化学方程式为。
(2)反应过程中持续通入N2的作用有两点:一是使反应产生的氨气完全导出并被稀硫酸充分吸收,二是。
(3)由MgCl2溶液得到MgCl2·6H2O晶体,操作为、 、
(4)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:。
②由MgCl2·6H2O加热制备无水MgCl2的操作在氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+ O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+ O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。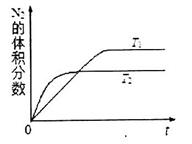
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v(N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。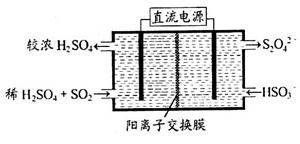
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)以H2O2和硼氢化合物NaBH4(B的化合价为+3价)作原料的燃料电池,可用作电解池的电源。其工作原理如图所示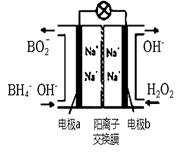
①写出a极上的电极反应式:,
②正极材料采用MnO2,MnO2除了作电极材料之外还可能具有的作用为