下列离子方程式书写正确的是
| A.碳酸氢铵溶液与足量氢氧化钠溶液反应 + OH-NH3·H2O |
| B.AlCl3溶液中加入足量的氨水:Al3++ 4NH3•H2O══AlO2-+4NH4++2H2O |
| C.向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全 2Al3++ 3SO42-+ 3Ba2++ 6OH-2Al(OH)3↓+ 3BaSO4↓ |
| D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
已知乙烷的燃烧热为1190kJ/mol,则下列表述正确的是()
| A.2C2H6(g)+7O2 (g) = 4CO2 (g)+6H2O(l);△H=-1190kJ/mol |
| B.C2H6(g)+7/2O2 (g) =2CO2 (g)+3H2O(g);△H=-1190kJ/mol |
| C.298k、101kPa时,30g乙烷气体完全燃烧生成CO2气体和液态水,放出1190kJ热量; |
| D.该反应中,反应物所具有的总能量小于生成物所具有的总能量。 |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O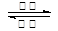 Cd(OH)2 + 2Ni(OH)2
Cd(OH)2 + 2Ni(OH)2
有关该电池的说法正确的是()
| A.充电时阳极反应:Ni(OH)2-e— + OH-="==" NiOOH + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
已知在发射卫星时可用肼(N2H4)为燃料和NO2作氧化剂,两者反应生成N2和水蒸气。
又知:N2(g)+2O2(g)===2NO2(g) ΔH=+67.7kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534kJ·mol-1
则肼与NO2反应的热化学方程式为()
| A.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=+567.85kJ·mol-1 |
| B.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(g) ΔH=-567.85kJ·mol-1 |
| C.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(l) ΔH=+567.85kJ·mol-1 |
| D.N2H4(g)+NO2(g)===3/2N2(g)+2H2O(l) ΔH=-567.85kJ·mol-1 |
下列图像能正确地表达可逆反应3A(g) + B(g) 2C(g)(△H<0)的是()
2C(g)(△H<0)的是()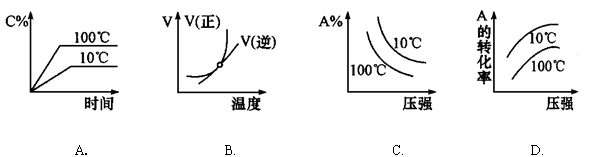
一定量的Fe和Fe2O3混合物投入2 mol·L-1 250 mL的HNO3溶液中,反应完全后,无固体剩余,生成1.12 L NO气体(标准状况),再向反应后溶液中加入1 mol·L-1的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是()
| A.450 mL | B.500 mL | C.400 mL | D.无法确定 |