(I)一定温度下,向Na2CO3溶液中加入BaCl2和K2SO4,当两种沉淀共存时,
C(CO32-)/C(SO42-)= 。[已知KspBaSO4=1.3ⅹ10-10,KspBaCO3=2.6ⅹ10-9]
(II)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g) N2O4(g) H =-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)
N2O4(g) H =-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡。其它条件不变时,下列措施能提高NO2转化率的是 。
N2O4(g)达到平衡。其它条件不变时,下列措施能提高NO2转化率的是 。
| A.减小NO2的浓度 | B.降低温度 | C.增加NO2的浓度 | D.升高温度 |
(2)25 ℃时,1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则反应2N2H4(l)+N2O4(l) = 3N2(g)+4H2O(l)的H = kJ·mol-1。
(3) 17 ℃、1.01×105 Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,
c(NO2) =" 0.0300" mol·L-1、c(N2O4) =" 0.0120" mol·L-1。 则反应2NO2(g) N2O4(g)的
N2O4(g)的
平衡常数K = 。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2混合气体(17 ℃、1.01×105 Pa),理论上至少需消耗Cu 克。
化合物D是硅橡胶的稳定剂,其合成路线如下图
(1)B的分子式为; C中官能团名称。
(2)C→D的反应类型为。
(3)B→C的化学方程式为。
(4)化合物D可能具有的性质有(选填序号)。
a.与FeCl3溶液发生显色反应 b.加成反应 c.消去反应 d.酯化反应
(5)化合物B经3步反应可制备 ,反应类型依次是(选填序号)。
,反应类型依次是(选填序号)。
a.加成、 取代、 消去 b.消去、加成、取代 c.取代、消去、加成
(6)写出同时满足下列条件的A的一种同分异构体的结构简式。
①核磁共振氢谱只有一个峰 ②分子中没有碳碳双键也无环状结构
今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
| 第一电离能 |
电负性 |
晶格能 |
沸点 |
| MgAl |
OS |
MgOMgS |
H2OH2S |
(3)基态铬原子外围电子轨道表示式为。
(12分)I. 乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为。
(2)下列物质中,不可以通过乙烯加成反应得到的是(填序号)。
| A.CH3CH3 | B.CH3CHCl2 |
| C.CH3CH2OH | D.CH3CH2Br |
(3)已知 2CH3CHO+O2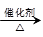 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。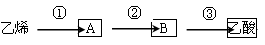
工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为,反应类型是。
II. 在实验室可以用如右下图所示的装置制取乙酸乙酯,请回答下列问题。
(1)乙醇、乙酸分子中官能团的名称分别是、。
(2)试管a中发生反应的化学方程式为,反应类型是。
(3)浓H2SO4的作用是:。
(4)反应开始前,试管b中盛放的溶液是。
(8分)试用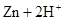 ══
══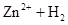 ↑的反应设计原电池。
↑的反应设计原电池。
(1)原电池中使用的电解质溶液是;
(2)写出电极反应式:
负极:,
正极:;
(3)在方框中画出此原电池的图,并标出电极材料的名称。
化学方程式默写
(1)单质钾与水反应
(2)乙醇与金属钠反应
(3)乙醇在铜或银做催化剂下氧化
(4)苯和液溴反应