下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应①②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G为极易溶于水且易液化.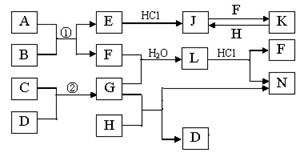
(1)化合物A中含有的短周期元素是 (写元素符号),E的化学式_______。
(2)如何检验化合物N中的阳离子 。
(3)写出J与F反应的离子方程式: ,G与H反应的化学方程式: 。
(4)等物质的量F和H的混合气体通入品红溶液中的现象为 ,原因是(用化学反应方程式表示) 。
(5)已知C与D反应生成1.7g G 时放出4.26kJ的热量,则该反应的热化学方程式为
。
已知有关物质的熔沸点数据如下表:
| MgO |
Al2O3 |
MgCl2 |
AlCl3 |
|
| 熔点/℃ |
2852 |
2072 |
714 |
190 |
| 沸点/℃ |
3600 |
2980 |
1412 |
182.7 |
请参考上述数据填空和回答问题。
(1)工业上常用电解熔融MgCl2的方法生产金属镁,而不用电解电解MgO的方法生产镁。
(2)工业上用电解Al2O3与冰晶石熔融混合物的方法生产铝,而不用电解AlCl3的方法生产铝,冰晶石在炼铝过程中的作用是。
(1)炼钢和炼铁都利用氧化还原反应,但炼铁是有,其核心反应是。而炼钢主要是用,其除碳的反应为。
(2)炼铁时常用的焦炭形成还原剂,能用煤代替吗?,为什么?
(3)检查钢质设备完好性的方法之一是:在被怀疑有裂纹处涂上10%的盐酸,过一段时间如观察到有粗线裂纹,表明该部分原先确有裂纹,产生粗线裂纹的原因是
某种ABS工程树脂,由丙烯腈(CH2= CHCN,符号A)、1,3-丁二烯(符号B,CH2="CHCH=" CH2)和苯乙烯(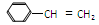 ,符号S),按一定配比共聚而得。
,符号S),按一定配比共聚而得。
(1)A、B和S 三种单体中,碳氢比(C﹕H)值最小的单体是。
(2)经元素分析知该ABS样品的组成为CaHbNc(a、b、c为正整数),则原料中A和B的物质的量之比是(用a、b、c)。
科学家把药物连接在高分子载体上制成缓释长效药剂。阿斯匹林结构为: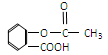 ;它可以连接在一高聚物载体上,形成缓释长效药剂,其中一种的结构简式为:
;它可以连接在一高聚物载体上,形成缓释长效药剂,其中一种的结构简式为: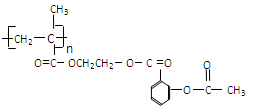
试回答:
(1)缓释长效阿司匹林的载体的结构简式为。
(2)服药后在人体内通过水解作用,可以缓慢地释放出阿司匹林,写出这个水解的化学方程式:。
(3)这种高分子载体是由单体发生聚合反应得到的。写出单体的结构简式。
Nomex纤维是一种新型的阻燃纤维。它可由间苯二甲酸和间苯二胺在一定重要条件下以等物质的量缩聚而成。请把Nomex纤维结构简式写在下面的横线上。
