有机物A是重要的合成原料,在医药、染料、香料等行业有着广泛的应用。由A可以制得麻黄碱和其他很多物质。现有如下转化关系图(略去了由A→G,G→麻黄碱的部分反应物和条件):
请回答下列问题:
(1)关于麻黄碱下列说法正确的是 (填字母)。
a.麻黄碱的分子式为C10H15NO
b.1mol麻黄碱可以对应消耗1molHCl或NaOH
c.麻黄碱可以发生消去和酯化反应
d.麻黄碱属于芳香烃
(2)已知有机物A的相对分子质量为106,A中含碳、氢、氧的质量之比为42:3:8,
则A的含氧官能团名称是 ;检验该官能团的实验是 。
(3)反应①~⑤中属于取代反应的是 (填序号)。
(4)写出D—B的化学方程式 。
(5)F可作多种香精的定香剂,请写出B和C反应生成F的化学方程式 。
(6)写出符合下列条件的同分异构体的结构简式 。
①与中间产物G互为同分异构体
②既能发生消去反应,又能发生酯化反应
③苯环上的一氯取代物只有两种,分子结构中没有甲基
(7)已知:
| |
溶解性 |
沸点 |
| A |
微溶于水 |
179.0℃ |
| E |
不溶于水 |
110.8℃ |
A可以由E制取,制取工艺中得到的是A、E混合物,分离该混合物的方法是 。
发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成。某小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由 组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:
(2)结合步骤①~③分析,气体A为 ,该发酵粉的成分为 (填化学式)。
(3)若步骤①和②操作不变(现象也相同),将步骤③中足量稀盐酸改为足量氯化钡溶液,观察到有白色沉淀生成,能否确定发酵粉的成分并说明理由: 。
(4)乙品牌的发酵粉的化学组成可能为假设2情况,请你设计实验验证。
实验仪器和用品任选,限选试剂:稀盐酸、0.1 mol/L NaOH溶液
写出实验步骤、预期现象和结论。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后,将溶液分成两份,分别装入A、B试管中 |
|
| 步骤2: |
,证明有Na+,发酵粉中有NaHCO3 |
| 步骤3: |
,结合步骤2中的结论,假设2成立 |
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。在纺织工业中用于棉织品漂白后的脱氯剂、染毛织物的硫染剂、靛蓝染料的防白剂、纸浆脱氯剂、医药工业中用作洗涤剂、消毒剂和褪色剂等,它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近7时,停止通入SO2 气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~450C左右干燥50~60min,称量。请回答以下问题:
(1)仪器b的名称是;
(2)步骤②中若控制PH值小于7,则产率会下降,请用离子方程式解释原因:。
(3)步骤③中不能将溶液蒸发至干的原因是;晶膜通常在溶液表面出现的原因是。
(4)步骤④中洗涤硫代硫酸钠晶体试剂的结构式是。
(5)下列有关抽滤的说法中,正确的是。
A.为了检验洗涤是否完全,应拔下吸滤瓶与安全瓶之间橡皮管,从吸滤瓶上口倒出少量洗涤液于试管中进行相关实验
B.抽滤前先用溶剂将滤纸湿润,使滤纸与漏斗底部贴紧
C.抽滤结束时应先关抽气泵,后抽掉抽滤瓶接管
D.在洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(6)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点。实验数据如下表:
| 实验序号 |
1 |
2 |
3 |
| Na2S2O3溶液体积(mL) |
19.98 |
20.02 |
21.18 |
则该产品的纯度是,间接碘量法滴定过程中可能造成实验结果偏低的是。
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时俯视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡
E.滴定时震荡锥形瓶较剧烈
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用废铁屑等物质为原料制备,并测定产品的纯度。相关反应的化学方程式为:Fe + H2SO4 =FeSO4 + H2↑ FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
回答下列问题:
(1)使用废铁屑前,往往将其在1.0mol.L-1Na2CO3溶液中浸泡数分钟,其目的是。然后使用(填写操作名称)分离并洗涤铁屑。
(2)析出的K3[Fe(C2O4)3]·3H2O晶体可通过如下图所示装置通过减压过滤与母液分离。下列关于减压过滤的操作正确的是。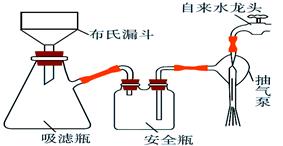
| A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸 |
| B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤 |
| C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤 |
| D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸 |
(3)使用高锰酸钾法(一种氧化还原反应滴定法)可以测定所得产品的纯度。若需配制浓度为0.03000 mol·L-1KMnO4标准溶液240mL,应准确称取g KMnO4(保留四位有效数字,已知M KMnO4=158.0g.mol-1)。配制该标准溶液时,所需仪器除电子天平、药匙、烧杯、玻璃棒外,还缺少的玻璃仪器有。配制过程中,俯视刻度线定容则导致所配溶液浓度(填“偏大”、“偏小”或“无影响”)。
(4)某同学称取2.000g产品,经预处理后配制成100mL溶液,移取25.00mL溶液于锥形瓶中,使用0.03000 mol·L-1KMnO4标准溶液滴定,消耗标准溶液10.00mL。
①实际进行滴定时,往往使用酸化的KMnO4标准溶液,写出该滴定反应的离子方程式。
②判断到达滴定终点的现象是。
③该产品的纯度为﹪(保留四位有效数字)。
草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如下图所示
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2︰1.25)
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:
C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
(1)上图实验装置中仪器乙的名称为:________________________。装置B的作用是。
(2)检验淀粉是否水解完全的方法:______________________________________________。实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:____________________________________________________。
(4)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下对比实验;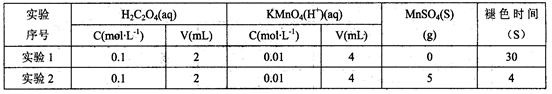
由此你认为溶液褪色总是先慢后快的原因是_________________________________________。
(5)草酸亚铁在工业中有重要作用,草酸可以制备草酸亚铁,步骤如下:
称取FeSO4·7H2O固体于小烧杯中,加入水和少量稀H2SO4溶液酸化,加热溶解。向此溶液中加入一定量的H2C2O4溶液,将混合溶液加热至沸,不断搅拌,以免暴沸,待有黄色沉淀析出并沉淀后,静置。倾出上清液,再加入少量水,并加热,过滤,充分洗涤沉淀,过滤,用丙酮洗涤固体两次并晾干。
①生成的草酸亚铁需充分洗涤沉淀,检验是否洗涤完全的方法是。
②用丙酮洗涤固体两次的目的是。
K3[Fe(C2O4)3]·3H2O[三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应过程如下。请回答下列问题: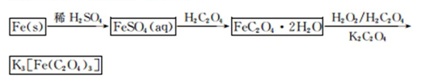
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是(填序号)。
(2)在得到的FeSO4溶液中需加入少量的H2 SO4酸化,目的是,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。
步骤⑤的目的是。
(4)C2O 可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化为CO2气体,故实验产物中K3[Fe(C2O3)3]·3H2O含量测定可用KMnO4标准溶液滴定。
①写出滴定过程中发生反应的离子方程式。
②下列滴定操作中使滴定结果偏高的是(填序号)。
| A.滴定管用蒸馏水洗涤后,立即装入标准液 |
| B.锥形瓶在装待测液前未用待测液润洗 |
| C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
| D.读取标准液体积时,滴定前仰视读数,滴定后俯视读数 |
③取产物10.0 g配成100 mL溶液,从中取出20 mL于锥形瓶中,用浓度为0.1mol·L-l的酸性KMnO4溶液滴定,达到滴定终点时消耗酸性KMnO4溶液24.00mL,则产物中K3 [Fe(C2O4)3]·3H2O的质量分数为[已知摩尔质量M{ K3[Fe(C2O4)3]·3H2O)="491" g·mol-l]。