某学生探究AgCl、Ag2S沉淀转化的原因。
| 步 骤 |
现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 |
产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 |
沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 |
较长时间后,沉淀变为乳白色 |
(1)Ⅰ中的白色沉淀是 。
(2)Ⅱ中能说明沉淀变黑的的离子方程式是 ,沉淀转化的主要原因是 。
(3)滤出步骤Ⅲ中乳白色沉淀,推测含有AgCl。用浓HNO3溶解,产生红棕色气体,部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀
ⅱ.向Y滴加KI溶液,产生黄色沉淀
①由ⅰ判断,滤液X中被检出的离子是 。
②由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有AgCl和另一种沉淀______。
(4)该学生通过如下对照实验确认了步骤Ⅲ中乳白色沉淀产生的原因:在NaCl存在下,氧气将Ⅲ中黑色沉淀氧化。
| 现 象 |
B:一段时间后,出现乳白色沉淀 |
| C:一段时间后,无明显变化 |

①A中产生的气体是_________。
②C中盛放的物质W是_________。
③该同学认为B中产生沉淀的反应如下(请补充完整):
2Ag2S +  +
+  + 2H2O
+ 2H2O  4AgCl +
4AgCl +  + 4NaOH
+ 4NaOH
④B中NaCl的作用是_______。
(8分)溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物,根据下面的探究实验回答问题。
(1)用下图所示装置进行实验:该实验的目的是;
试管II中观察到的现象是;
装置I的作用是。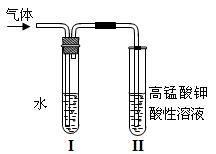
(2)若用另一实验来达到上述实验的目的,实验方案依据的反应原理是
_____(用化学方程式表示)。
某学生设计了一个制取氢氧化亚铁的最佳实验方案,实验装置见图,请分析实验过程:
⑴在B试管中加入NaOH溶液后加热煮沸1—2分
钟立即加入2mL液体石蜡,该操作目的是_______________ ________。
⑵在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为什么铁粉过量_________________________。
⑶连接好导管,同时打开活塞,当铁粉与稀硫酸反应平稳时,关闭活塞,这时A试管中的现象为____________________,原因是_______。B试管中现象为__。
Ⅰ.将刮去氧化膜的镁片投入沸水中,反应的化学方程式为 。
Ⅱ.若用灼热的镁粉与水蒸气反应,则在生成H2的同时还可能得到氧化镁粉未。为实现这一反应并收集一瓶H2,某课外活动小组设计了如图所示的装置。
(1)实验开始时,应先点燃 (填“A”或“B”)处的酒精灯, 等观察到 ,再点燃另一酒精灯。这样做的目的是 。
等观察到 ,再点燃另一酒精灯。这样做的目的是 。
(2)若将装置D与干燥管相连,则所连导管口应为 (填“m”或“n”),这种方法叫 (填“向上”、“向下”)排气法
(3)小试管C的作用是 。
(4)装置E的作用是检验集气瓶中是否收集满了H2,则检验的操作和需要观察的现象是 。
(5)反 应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能M
应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能M g和Mg(OH)2任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。
g和Mg(OH)2任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。
某研究性学习小组在研究由Fe2+制备Fe(OH)2的 过程中,设计了如下实验方案:
过程中,设计了如下实验方案: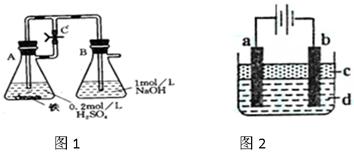
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有:
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:
①纯水②NaCl溶液③NaOH溶液④四氯化碳⑤CuCl2溶液⑥乙醇⑦Fe棒⑧植物油⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
某未知溶液X中可能含有K+、Fe2+、NH4+、Cl-。检验其中是否含有K+,通常有如下两套实验方案。
方案一:焰色反应法
用洁净的玻璃棒蘸取 未知液X置
未知液X置 于酒精灯外焰上灼烧,观察到火焰呈黄色,则证明其中不含K+。对上述实验过程中的错误和疏漏之处加以纠正、补充:
于酒精灯外焰上灼烧,观察到火焰呈黄色,则证明其中不含K+。对上述实验过程中的错误和疏漏之处加以纠正、补充:
、。
方案二:亚硝酸钴钠法
在CH3COOH酸化的溶液中,K+与亚硝酸钴钠[Na3Co(NO2)6]反应生成黄色沉淀[K2NaCo(NO2)6],该原理可用于K+的检验。注意:NH4+也能与Na3Co(NO2)6生成黄色沉淀,会干扰K+离子的检验。
请你利用上述反应原理设计一个实验方案,检验未知溶液X中是否含有K+。