U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。请回答下列问题:
(1)UW2的结构式为______________;XW的电子式为__________________;
(2) V、W、X三种元素组成的化合物中化学键的类型为______________。
(3)U、V形成的10电子氢化物中沸点较低的是(写化学式)_______;理由:
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为__________________。由此可知VW和YW2还原性较强的是(写化学式)____________。
I. (1)在Al2(SO4)3和MgSO4组成的混合物中,Al3+与Mg2+的物质的量之比为2∶3,则在含有4 mol SO42-的混合物中,MgSO4的质量是______________克。
(2)V ml Al2(SO4)3溶液中含有Al3+ a g,取V/4 ml溶液稀释到4V ml,则稀释后溶液中SO42-的物质的量浓度是______________ mol/L。
II.在120 ℃时分别进行如下四个反应:
| A.2H2S (g) + O2 (g) ==2H2O (g)+2S (s) | B.2H2S (g)+3O2 (g)==2H2O (g)+2SO2 (g) |
| C.C2H4(g)+3O2 (g)==2H2O (g)+2CO2 (g) | D.C4H8 (g)+6O2 (g)==4H2O (g)+4CO2 (g) |
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和p前>p后的是__________;符合关系式d前=d后和p前=p后的是__________。(请填写反应的代号)
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是________;符合d前>d后和V前>V后的是________。(请填写反应的代号)
酸、碱、盐溶液能够导电,是因为物质溶于水时,离解成为自由移动的阴、阳离子。在酸的溶液里,酸根离子所带负电荷的总数等于酸电离时生成的H+的总数:
(1)下列物质的电离方程式如下:HClO4═H++ClO4-; Ba(OH)2═Ba2++2OH-;
Fe2(SO4)3═2Fe3++3SO42-; KHSO4═K++H++SO42-.
属于酸的物质____________________(写化学式);
(2)化工生产常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是____________________。
②上述物质中既不是电解质也不是非电解质的是________________________。
(3)写出下列物质在水溶液里的电离方程式:
①NaHCO3 ___________________②H2SO4________________________
(4)有人说可将无机化合物KHSO4与NaHCO3归为同一类别,你认为他的理由主要是___________________;有人说可将无机化合物KHSO4与H2SO4归为同一类别,你认为他的理由主要是__________________;
(5)若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为2:1混合,该反应的离子方程式为:_______________________;
若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为1:1混合,该反应的离子方程式为:_______________________;
某化学课外活动小组用海带为原料制取少量碘水,现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,其实验操作可分解为如下几步:
| A.把盛有溶液的分液漏斗放在铁架台的铁圈中; |
| B.把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞; |
| C.检验分液漏斗活塞和上口的玻璃塞是否漏液; |
| D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; |
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗上口倒出上层溶液;
G.将分液漏斗上口玻璃塞打开或使塞上的凹槽或小孔对准分液漏斗口上的小孔;
H.静置、分层。
(1)正确操作步骤的顺序是(用上述各操作的编号字母填写):
________→________→________→A→________→G→E→F。
(2)上述E步骤中下层液体为___________色的__________溶液,E步骤操作中应注意:_________________________________。
(3)上述G步骤的操作的目的是:________________________。
(4)能用CCl4从碘水中萃取碘的原因是:_______________________。
I、标准状况下,1体积水中能溶解500体积的HCl气体。若向水中通入标准状况下的44.8LHCl气体配成1L溶液,假设气体完全溶解。请回答:
(1)所得溶液中含HCl的物质的量浓度为 ;
(2)从该溶液中取出10mL溶解于水配制成250mL溶液,配制后的稀溶液中含HCl物质的量浓度为 。
(3)配制过程中,造成浓度偏低的操作可能有_______________(选填下列操作的序号)。
| A.容量瓶用蒸馏水洗后未干燥 |
| B.量筒用蒸馏水洗后未干燥 |
| C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量中加水到刻度 |
| D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线 |
E、定容时,俯视液面加水至刻度线
II.实验室欲用NaOH固体配制所需的480mL 1.0mol/L的NaOH溶液: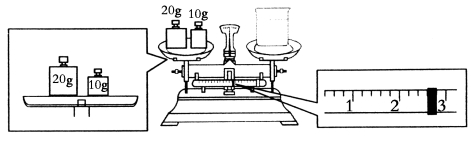
(1)配制时,必须使用的玻璃仪器有________、________、________、________。
(2)要完成本实验该同学应称出NaOH________g。
(3)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图,烧杯的实际质量为________g。
(4)使用容量瓶前必须进行的一步操作是________。
某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 |
溶液中检测出的物质 |
| 第一次 |
KCl、K2SO4、Na2CO3、NaCl |
| 第二次 |
KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 |
Na2SO4、KCl、K2CO3、NaCl |
(1)三次检测结果中第 次检测结果不正确。
(2)在检测时,为确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子:首先,向溶液中滴加 溶液(填化学式),其目的是 ;然后,继续加入过量的该溶液,其目的是 ;
第三,再向溶液中加入过量 溶液(填化学式),其目的是 ;
第四,过滤,再向滤液中加入 溶液(填化学式),其目的是 。