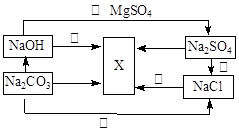已知:
① N2 (g) + 2O2 (g) = 2NO2 (g) △H1 =" +" 67.7kJ/mol
②N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H2 = -534kJ/mol
③1/2H2 (g) + 1/2F2 (g) = HF (g) △H3 = -269kJ/mol
④H2 (g) + 1/2O2 (g) = H2O (g) △H4 = -242kJ/mol
⑤H2O(l)====H2O(g) △H5=+44kJ·mol-1
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出液态肼和足量H2O2反应的热化学方程式_______________________________。
(2)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(3)16 g气态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(4根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式______________ ______________________。
(5)有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式: 。
在一定条件下,反应A(气)+B(气) C(气)+Q达到平衡后,根据下列图象判断
C(气)+Q达到平衡后,根据下列图象判断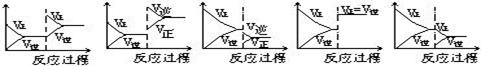
| A. | B. | C. | D. E. |
(1)升温,达到新的平衡的是 (2)降压,达到新的平衡的是
(3)减少C的量,移向新平衡的是(4)增加A的量,移向新平衡的是
(5)使用催化剂,达到平衡的是
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
(1)压强 P1比P2(填大或小);
(2)(a +b)比(c +d)(填大或小);
(3)温度t1℃比t2℃(填高或低);
(4)正反应为反应。
在密闭容器中进行可逆反应:
CO(气)+NO2(气) CO2(气)+NO(气)△H<0,达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(气)+NO(气)△H<0,达到平衡后,只改变其中一个条件,对平衡的影响是:
(1)增大容器的体积,平衡 ,反应混合物的颜色 。
(2)通人CO2气体,平衡 ,反应混合物的颜色 。
(3)加入催化剂,平衡 。
如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5 mL 盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式:
(4)由实验推知,MgCl2溶液和H2的总能量(填“大于”“小于”或“等于”)镁片和盐酸的总能量.
根据下图所示,推断物质X的化学式。X的化学式