一定温度下,在容积固定的VL密闭容器中加入nmolA、2nmolB,发生反应:A(g)+2B(g)  2C(g) △H<0,反应达到平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) △H<0,反应达到平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡,则下列说法中正确的是_______________(填字母)。
A.物质A、B的转化率之比为1:2
B.起始时刻和达到平衡后容器中的压强之比为3n:(3n-nx)
C.充入惰性气体(如Ar),平衡向正反应方向移动
D.当2v正(A)=v逆(B)时,反应一定达到平衡状态
(2)K和x的关系满足K=__________(用含V、n、x的表达式表示)。
(3)该反应的逆反应速率与时间的关系如图所示:

①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都仅改变了一种条件,试判断改变的条件:
t2时____________;t8时____________。
②t2时平衡向_________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率随时间变化的曲线。
工业合成氨反应:N2+3H2 2NH3,在一定条件下已达到平衡状态。
2NH3,在一定条件下已达到平衡状态。
(1)若降低温度,会使上述平衡向生成氨的方向移动,生成每摩尔氨的反应热数值是46.2KJ/mol,则该反应的热化学方程式为。
(2)若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)="1.2mol," n(H2)="1.2mol," n (NH3)=0.8mol,则反应速率V(N2)=mol·L-1·min-1,H2的转化率=,平衡常数=。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡(填向左﹑向右或不移动)移动。
(3)若在恒温恒压条件下,将1 molN2与3 molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,这时N2的物质的量为mol,(用含a的代数式表示);若开始时只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N23mol,H2 =mol(平衡时NH3的质量分数与前者相同);若开始时通入x molN2﹑6molH2和2mol NH3,达平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x=mol,y=mol(用含a的代数式表示)
已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料。它们有如图所示的转化关系。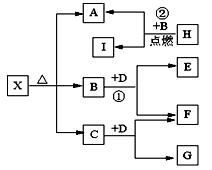
试回答下列问题
(1)X的化学式为:;G的电子式为。
(2)写出下列反应的化学方程式
①②。
(3)H与同周期原子序数比其大一的另一种金属组成原电池,H作正极,则负极反应式为,电解质溶液为。
(4)H的工业制法可用电解原理,当阳极产生可使湿润的淀粉KI试纸变蓝的气体1.12升(标况)时,阴极生成H克,有关化学方程式为。
美日三名化学家[理查德·赫克(Richard Heck,美)、根岸荣—(Ei – ich Negishi,日)、铃木章(Akira Suzuki,日)利用钯(Pd)作催化剂,将有机化合物进行“裁剪”、“缝合”,创造出具有特殊功能的新物质而荣获2010年诺贝尔化学奖。赫克反应(Heck反应)的通式可表示为(R – X中的R通常是不饱和烃基或苯环;R′CH=CH通常是丙烯酸酯或丙烯腈等):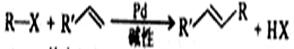
现有A、B、C、D等有机化合物 有如下转化关系:
有如下转化关系: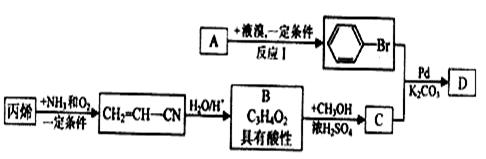
请回答下列问题:
(1)反应I的化学方程式为。
(2)已知腈基(—C≡N)也具有不饱和性(可催化加氢),写出CH2=CH—CN完全催化加 氢的化学方程式:。
氢的化学方程式:。
(3)丙烯腈(CH2=CH—CN)可发生加聚反应生成一种高聚物,此高聚物的结构简式为
。
(4)写出B转化为C的化学方程式:。
(5)D的结构简式为。
(6)D具有化学性质有(填编号)。
A.加热能与氢氧化钠溶液反应
B.能使溴的四氯化碳溶液褪色
C.能发生缩聚反应和加聚反应
D.能使酸性高锰酸钾溶液褪色
(7)已知:醛基直接与苯环连接的醛如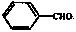 不能被新制的氢氧化铜氧化。写出同时符合下列条件的D的同分异构体的结构简式:。
不能被新制的氢氧化铜氧化。写出同时符合下列条件的D的同分异构体的结构简式:。
①波谱分析显示分子中没有甲基;
②1,3,5—三取代苯;
③具有酸性,既能与Fe3+作用显色,又能使溴水褪色,易被新制的氢氧化铜氧化
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。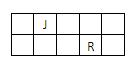
(1)元素T的名称是
(2)J和氢元素组成的化合物A每个分子由4个原子组成,已知充分燃烧a gA物质时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则A物质燃烧热的热化学方程式是
(3)工业燃烧焦炭后的尾气中含有M和R组成的气体,为了测定其含量,可以选择的试剂是
| A.氢氧化钠溶液 | B.硫酸酸化的高锰酸钾溶液 | C.淀粉碘化钾溶液 | D.溴水溶液 |
(4)在微电子工业中,L的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为:
(5)由L和M组成的两种价态相同的气体化合物可以相互转化,在同温同容的甲乙容器中分别加入1mol和2mol的LM2气体,分别建立平衡,则两容器中LM2的转化率比较甲乙(<,>,=)
(6)与J同主族的另一短周期元素和M组成的化合物有很广泛的用途,请说出其主要应用,写出两种。
常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
(1)写出MOH的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)_______;
此时,混合溶液中由水电离出的c(H+)___ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)分别写出B、C两点,混合溶液中各离子浓度的大小关系
B点______________;C点_____ ________;
________;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L。