化合物A(C4H10O)是一种有机溶剂。A可以发生以下变化: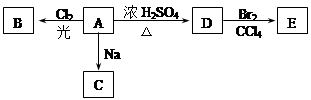
⑴A、D分子中的官能团名称分别是______________、_______________。
⑵A只有一种一氯取代物B。写出由A转化为B的化学方程式: 。
⑶ A的同分异构体F也可以有框图内A的各种变化,且F烃基上的一氯取代物有三种。F的结构简式是___________________________________________。
⑷A与化合物“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”。已知“HQ”(C6H6O2)可以与三氯化铁溶液发生显色反应,且“HQ”的一硝基取代物只有一种,则“HQ”的结构简式为___________________________。
有机物A为茉莉香型香料。
(1)A分子中含氧官能团的名称是__________________________________________________。
(2)C的分子结构可表示为(其中R和R′代表不同的烃基):
A的分子式是____________,A可以发生的反应是____________(填写序号字母)。
a.还原反应b.消去反应c.酯化反应d.水解反应
(3)已知含有烃基R的有机物R—OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机物R′—OH的类别属于____________。
(4)A分子结构中只有1个甲基,A的结构简式是____________________________________。
(5)在浓硫酸存在下,B与乙醛共热生成化合物C16H22O2的化学方程式是________________________________________________。
(6)在A的多种同分异构体中,分子结构中除烃基R′含有三个甲基外,其余部分均与A相同的有____________种。
已知柠檬醛的结构简式如下: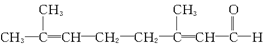
(1)检验柠檬醛分子中含有醛基的方法是________________________________________。
(2)已知溴水可氧化醛基,若要检验柠檬醛分子中含碳碳双键的方法是__________________。
有两种有机化合物A和B,分子式分别为C2H6O和C2H4O,已知:
①B氧化得C,还原得A;
②A能脱水生成烯烃F;
③F能跟溴水反应得D;
④D与氢氧化钠水溶液反应,得到溶于水的产物E。
(1)写出A和B的结构式。
(2)写出上述①至④各反应的化学方程式,并对E命名。
下面是合成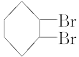 的流程图示:
的流程图示: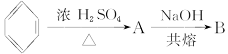 (另有Na2SO4和水生成)
(另有Na2SO4和水生成)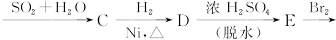

(1)写出五种物质中有机物的结构简式:
A__________;B__________;C__________;D__________;E__________。
(2)写出生成B和C的反应方程式__________________________________________________。
将煤焦油中混有的苯、甲苯与苯酚进行分离,可采取如图所示的方法进行操作: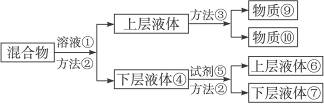
(1)写出物质①和⑤的化学式:①为________,⑤为________。
(2)写出分离方法:②为________法,③为________法。
(3)混合物中加入溶液①反应的化学方程式________________________。
(4)下层液体④变成⑥⑦的方程式为______________________________。
(5)分离出的苯酚在________里(写编号)。