下列为实验室常用的实验装置,回答问题:
| A. |
|
B. |
|
C. |
|
D. |
|
E. |
|
(1)写出带有标号仪器的名称:①;②。
(2)用锌和稀硫酸制取氢气,应选用的发生装置是(填序号,下同),收集装置是。
(3)实验室常用稀盐酸和石灰石反应制
,该反应的化学方程式;
此外,也可用加热碳酸氢钠(
)固体(产物为碳酸钠、二氧化碳、水)来制取
,该反应的化学方程式,若用此法来制取
,应选用的发生装置为,收集装置为。
(4)右图所示装置可用来测量生成的
的体积,其中在水面上放一层植物油的目的是,植物油上方原有的空气对实验结果(填"有"或"无")明显影响。

根据如图所示装置回答下列有关问题:

(1)仪器x的名称是 ;
(2)若用装置B收集氧气,进气口应为 端(选填"a"或"b");
(3)对比装置C和D,可以得出关于可燃物燃烧的条件是 ;
(4)某同学连接A、E、F进行实验,A中所加药品不同,F中所加药品相同.
①若实验时E中蜡烛熄灭,F中溶液变浑浊,则E中现象说明A中产生的气体所具有的性质是 ;
②若实验时E中蜡烛燃烧更旺,F中溶液变浑浊,则A中反应的化学方程式为 .
人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属.硅钢可用于制造变压器的铁芯,某化学兴趣小组的同学为了验证硅钢(主要含有Fe、C、Si),设计了如图的实验流程(有些反应的部分反应物和生成物已省略).
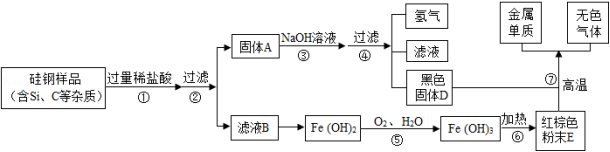
查阅资料发现:常温下,单质硅(Si)不能与盐酸反应,但能与氢氧化钠溶液反应(Si+2NaOH+H 2O═Na 2SiO 3+2H 2↑).
根据以上信息,回答下列问题:
(1)固体A的成分为 ,E的化学式为 ;
(2)滤液B中的金属阳离子为 ;
(3)在过滤操作时,若发现滤液浑浊,应 ;
(4)步骤⑤中发生的是化合反应,尝试写出其化学方程式 .
初中化学中,我们学习了酸和碱发生中和反应的实质是H ++OH ﹣═H 2O.如图,像这种用实际参加反应的离子符号来表示反应的式子叫离子方程式。离子方程式的书写一般按以下步骤:(以Na 2SO 4与BaCl 2反应为例)
①写出Na 2SO 4与BaCl 2反应的化学方程式: ;
②把易溶于水、易电解的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成:2Na ++SO 4 2﹣+Ba 2++2Cl ﹣═BaSO 4↓+2Na ++2Cl ﹣
③删去方程式两边不参加反应的离子:Ba 2++SO 4 2﹣═BaSO 4↓
④检查方程式两边各元素的原子个数和电荷总数是否相等。
请回答:
(1)下列各组中的离子,在pH=3的水溶液中能大量共存的是
A、Na +、Mg 2+、Cl ﹣、SO 4 2﹣ B、Na +、K +、Cl ﹣、OH ﹣
C、Na +、Cu 2+、Cl ﹣、SO 4 2﹣ D、Na +、K +、Cl ﹣、CO 3 2﹣
(2)写出稀盐酸滴在石灰石上所发生反应的离子方程式 ;
(3)写出一个与离子方程式Mg+2H +═Mg 2++H 2↑相对应的化学方程式 ;
(4)酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离子的反应,只要具备生成物中有气体或沉淀或 生成,反应就能发生。

我市著名的纸面石膏板企业,用热电厂燃烧煤产生的炉渣来生产石膏板.原理是:发电过程中产生的烟气中含有大量的SO 2,热电厂用"碱﹣石灰﹣石膏(CaSO 4•2H 2O)"的方法使烟气脱硫从而生成石膏.
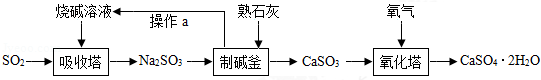
(1)工业烟气没经处理直接排放到空气中易形成 ,会污染、破坏环境;
(2)写出吸收塔内发生反应的化学方程式 ;工业上用分离液态空气法制氧气,是利用空气中各成分的 不同进行分离的;
(3)化学反应类型有不同的分法,其中反应前后,有元素化合价变化的化学反应是氧化还原反应.有元素化合价升高的反应物是还原剂,有元素化合价降低的反应物是氧化剂.化学反应前后元素化合价没有变化的化学反应是非氧化还原反应.则下列说法正确的是
A、吸收塔、制碱釜中发生反应属于氧化还原反应
B、制碱釜中的反应物Na 2SO 3作氧化剂
C、氧化塔中发生的反应属于氧化还原反应
D、氧化塔中的反应物CaSO 3作还原剂
(4)生产流程中生成的 可循环利用,节约成本.
实验技能是学习化学和进行探究活动的基础和保证。

(1)实验室配制50g质量分数为6%的NaCl溶液,用到的玻璃仪器除试剂瓶、量筒、胶头滴管外,还需要 。量取读数时,如图视线角度正确的是 (填序号)。
(2)请根据如图装置或操作回答相关问题。
①选取图2中的序号,表示粗盐提纯的正确操作顺序为 。操作B的名称是 ,该操作中当 时,应停止加热。
②实验室用高锰酸钾固体制取氧气时,可选用的发生装置是 (填序号)。