如图装置中,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹,a、b为电源两极.在A、B中充满KOH溶液后使其倒立于盛有KOH溶液的水槽中.切断K1,闭合K2、K3,通直流电,电解一段时间后A、B中产生体积不相等的无色气体,如图所示. 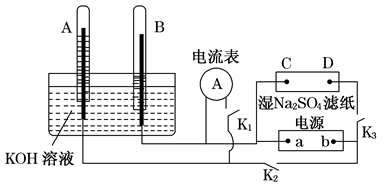
(1)试管B中收集的气体是 (填化学式)电源的a极为 (填“正极”或“负极”).
(2)写出铂夹C上发生的电极反应式:
(3)写出A中电极反应式: .
(4)若电解一段时间后A、B中均有气体包围电极.此时切断K2、K3,闭合K1,电流表的指针发生偏转,此时B极的电极反应式为 .
(1)某温度下,2L恒容密闭容器中,X、Y、Z三种气体发生化学反应时,物质的量随时间变化的关系曲线如图所示,则
①此反应的化学方程式为________________;
②0~10s内,用Z表示的化学反应速率为_____________;
③X的转化率为________________;
(2)恒温恒容时,某密闭容器中发生反应:
C(s)+CO2(g)  2CO(g),下列描述中能说明该反应已达到化学平衡状态的是_____。
2CO(g),下列描述中能说明该反应已达到化学平衡状态的是_____。
①C(s)的浓度不再改变
②CO2的体积分数不再改变
③气体的质量不再改变
④气体的密度不再改变
⑤单位时间内消耗1molCO2,同时生成2molCO
⑥n(CO2):n(CO)=1:2 ⑦v正(CO2)=2v逆(CO)
Ⅰ.① H与
H与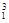 H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷
H;②O2与O3;③正丁烷(CH3CH2 CH2 CH3)与异丁烷 ;④甲烷(CH4)与丙烷(C3H8)。
;④甲烷(CH4)与丙烷(C3H8)。
(1)互为同位素的是______(填序号,下同)。
(2)互为同系物的是______。
(3)互为同分异构体的是______。
(4)互为同素异形体的是______。
II.A~E等几种烃分子的球棍模型如下图所示,据此回答下列问题。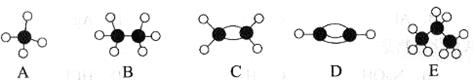
(1)D的化学式为__________________,A的二氯取代物有____________种。
(2)可作为植物生长调节剂的是________________________(填序号)。
Ⅰ、分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途。
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图
①下列对尼泊金酯的判断正确的是。
a.能发生水解反应
b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上
d.能与浓溴水反应产生白色沉淀。
②尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是。
(2)C8H8O3的另一种同分异构体甲如图:
①请写出甲中所含官能团的名称,。
②甲在一定条件下跟Na反应的化学方程式是:。
③甲跟NaHCO3溶液反应的化学方程式是:。
Ⅱ、写出下列化学反应方程式:
(1)溴乙烷与NaOH的乙醇溶液共热:。
(2)将CO2通入苯酚钠溶液中:。
(3)1,3-丁二烯的与Br2的1、4加成反应:。
(4)葡萄糖与银氨溶液发生银镜反应:。
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,丁与辛属同周期元素,
(1)用元素符号表示甲、乙、丁的金属性从强到弱的顺序;
(2)用元素符号表示辛、己、戊的原子半径从大到小的顺序;
(3)丙与庚的原子核外电子数相差;
(4)戊单质电子式为,写出一种含戊、己两种元素的离子化合物的化学式。
焦炭是工业生产中的重要还原剂和燃料,活性炭用于生活和实验室中通过吸附作用除去有害气体或有毒物质。它们的化学成分都可以看成是碳单质。
(1)红热的焦炭投入浓硝酸中,写出反应的化学方程式;
(2)将一定条件下的高锰酸钾溶液与活性炭混合,可发生如下反应(未配平)
MnO4-+C+H2O——MnO2+①+CO32-
则 ① 处应该填入的微粒化学式为;
(3)PbO俗称密陀僧或铅黄,将黄色粉末状PbO和足量活性炭充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按图连接仪器。实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。同时,b瓶的溶液中出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却。此时,管中的熔融物凝固成银白色金属。
写出反应管a中发生的所有反应的化学方程式。