氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ/mol, N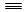 N键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式 ;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H = 。
N键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式 ;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H = 。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| c(NH3)/(mol/L) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,用N2浓度的变化表示的反应速率为 ,此条件下, 反应达到平衡的时间为: ,其化学平衡常数K= ;达到平衡后氨气的转化率为: 。
(1)制造普通玻璃的主要原料是纯碱、石灰石和 。
(2)油脂被摄入人体后,在酶的作用下水解为 和甘油(写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(3)发育出现障碍,患营养缺乏症,这主要是由于摄取________(填“蛋白质”、“脂肪”或“糖类”)不足引起的。下列食物中富含该物质的是 (填字母)。
| A.菠菜 | B.花生油 | C.瘦肉 | D.西瓜 |
下列常用物质: A 碳酸氢钠B 阿司匹林 C 葡萄糖 D 苯甲酸钠 E 柠檬黄请用字母填空:
具有解热镇痛疗效的是 ;可直接进入人体血液补充能量的是 ;可用作食品防腐剂的是 ;常用作食品着色剂的是 ;常用作治疗胃酸过多的抗酸剂的是 ,写出该抗酸药发挥功效时的化学方程式 。
防治环境污染,改善生态环境己成为全球的共识。
(1)垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有 (填字母)标志的垃圾筒内。
(2)工业废水需处理达标后才能排放。下列废水处理的方法合理的是 (填字母)。
a.用中和法除去废水中的酸 b.用混凝法除去废水中的重金属离子
c.用氯气除去废水中的悬浮物 d.用氧化还原法除油类、氰化物
(3)为了减少煤燃烧产生的SO2对大气造成的污染,可向煤中加入适量石灰石。石灰石与煤燃烧时产生的SO2及空气中的O2反应,生成CaSO4和CO2,写出该反应的化学方程 。
(4)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行 。对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为 。
用KMnO4氧化密度为1.19g·cm-3,溶质质量分数为36. 5%的HCl溶液。反应方程式如下:
KMnO4+ HCl=== KCl+ MnCl2+ Cl2↑+ H2O
(1)请配平方程,并用双线桥法表示该反应电子转移情况
(2)盐酸的物质的量浓度
(3)15.8gKMnO4能氧化 mol的HCl,转移电子数约为
有A、B、C、D四种无色可溶性盐分别是由Na+、Mg2+、Ag+、Ba2+、Cl-、CO32-、HCO3-、NO3-中不同的阴阳离子所组成。A溶液与硫酸反应只有气体生成,B溶液与硫酸反应只有沉淀生成,C溶液与硫酸反应既有气体又有沉淀生成,D溶液与硫酸反应既无气体又无沉淀生成,则
(1)D为 ;(写化学式)
(2)分别写出下列反映的三个离子方程式
①A与足量的硫酸溶液 ;
②C与足量的硫酸溶液 ;
③C与少量的氢氧化钠溶液 。