防治环境污染,改善生态环境己成为全球的共识。
(1)垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有 (填字母)标志的垃圾筒内。

(2)工业废水需处理达标后才能排放。下列废水处理的方法合理的是 (填字母)。
a.用中和法除去废水中的酸 b.用混凝法除去废水中的重金属离子
c.用氯气除去废水中的悬浮物 d.用氧化还原法除油类、氰化物
(3)为了减少煤燃烧产生的SO2对大气造成的污染,可向煤中加入适量石灰石。石灰石与煤燃烧时产生的SO2及空气中的O2反应,生成CaSO4和CO2,写出该反应的化学方程 。
(4)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量。为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行 。对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为 。
汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为2NO+2CO 2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
2CO2+N2.在密闭容器中发生该反应时c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
① T1_(填“>”“<”或“=”)T2。
② 在T2温度下,0~2s内的平均反应速率v(N2)=________。
(2)NO2、O2和熔融NaNO3可形成燃料电池,其原理如图所示。通入O2的一极为_______(填“正极”或“负极”),该电池在使用过程中石墨I电极上生成N2O5,其电极反应式为_________。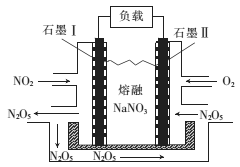
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为_____________________。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____(填“>”、“<”或 “=”,下同)c(N2O22-)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中 =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
铍作为一种新兴材料日益被重视,铍是原子能、火箭、导弹,航空、宇宙航行以及冶金工业中不可缺少的宝贵材料。
(1)13Be2+的中子数为_____,其结构示意图为_______。
(2)铍在氧气中燃烧,得到白色粉未状的氧化铍BeO,BeO的熔点为2803K,难溶于水,其熔融物难电离,化合物BeO的化学键类型为______(填“共价键”或“离子键”)。
(3)铍既能溶于酸也能溶于碱,与碱反应生成BeO22-。写出铍与NaOH溶液反应的离子方程式:_______________。
I.下列分子中,立体构型是平面三角形的是_____。
| A.CH4 | B.NH3 | C.BF3 | D.SO3 |
II.氟及氟产品在工农业生产中应用非常广泛,回答下列问题:
(1)基态氟原子核外电子的运动状态有______种,这些电子的电子云形状有______种;氟原子的外围电子排布式为________。
(2)NaHF2(氟化氢钠)电解可制氟气,NaHF2中所含作用力的类型有____;与HF2-互为等电子体的分子有______(举一例)。
(3)C2F4分子中,碳原子的杂化轨道类型为________。
(4)三氟化硼乙醚(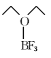 )的熔点为-58℃,沸点为126~129℃,它属于_____晶体。
)的熔点为-58℃,沸点为126~129℃,它属于_____晶体。
某学生课外活动小组模拟呼吸面具中的反应原理设计用图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0~50mL)供量气用,乙管可上下移动调节液面高低。
实验仪器:连接胶管及夹持装置均省略
实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。试回答:
(1)图中各装置接口连接顺序是 (填各接口的编号)。
(2)装置A的作用是 ,反应的化学方程式 。
(3)装置B的作用是 。反应的化学方程式为 。
(4)装置C中放入的反应物是 。
反应的化学方程式为 。
(5)装置D中可能发生的所有化学反应方程式为: 。