C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质。D元素的原子的最外层电子数是次外层电子数的3倍,C、G同周期,且原子最外层电子数相差4,它们的简单离子电子层结构不同。相互间有如下转化关系:
请填空:
(1) D与I能形成 原子个数比为1:1的共价化合物,请写出其分子式: ;
原子个数比为1:1的共价化合物,请写出其分子式: ;
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学式: 。
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%。反应①的化学方程式是 ,引发该反应的操作是
(4)写出A+F → J的离子方程式: 。
A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。请回答:
(1)用电子式表示A和C组成的化合物的形成过程为__________________;
(2)B离子的电子式是 ,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成盐,该分子的电子式是;
(3)周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是,(填氢化物化学式),原因是;
(4)写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式(本题涉及的含C元素的物质均易溶于水): 。
(1)按已知的原子结构规律,82号元素X应是第___________周期_________族元素,它的最高正价氧化物的化学式为______________。
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应_________填序号),写出反应⑥的化学方程式______。
(3)在下列化合物中:H2O2、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是,
②只有极性共价键的共价化合物是,
③只含有非极性共价键的是,
④既有离子键又有非极性键的化合物是。
(6分)某同学在学习沉淀溶解平衡时发现以下表中信息:
| AgCl |
AgBr |
Ag2CrO4 |
|
| 颜色 |
白色 |
浅黄色 |
砖红色 |
| 溶解度(mol·L-1) |
1.3×10-4 |
1.7×10-7 |
6.5×10-5 |
| 溶度积常数(KSP) |
1.7×10-12mol2·L-2 |
5.0×10-13mol2·L-2 |
? |
(1)请利用表中信息计算Ag2CrO4的溶度积常数KSP = ;
(2)沉淀滴定所用的指示剂本身就是一种沉淀剂,用AgNO3滴定KCl溶液中Cl-的含量时甲同学想用K2CrO4作指示剂;
①现有浓度均为0.001mol·L-1的KCl和K2CrO4的混合液,该同学取混合液20mL,用已知浓度的AgNO3溶液滴定,试计算当Cl-沉淀完全时,CrO42-是否开始沉淀(当溶液中某离子浓度小于1×10-5mol·L-1时认为沉淀完全)。
②根据表中信息和上述计算,请判断K2CrO4能否用作AgNO3滴定KCl实验的指示剂(填“能”或“不能”);若能则滴定终点的颜色变化是(若不能该空不填)。
如下图,甲、乙、丙分别表示在不同条件下可逆反应:
A(g)+B(g) xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t)的关系。
请根据图象回答下列问题:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则曲线表示无催化剂时的情况(填字母,下同);
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性气体后的情况,则曲线表示恒温恒容的情况;
(3)根据丙图可以判断该可逆反应的正反应是热反应(填“吸”或“放”),计量数x的值(填取值范围);判断的依据分别是 。
如图所示装置,X、Y为电源的两极,a、b均为石墨电极,c为铜电极,d为铁电极,A槽中盛装饱和食盐水,B槽中盛装CuCl2溶液。通电一段时间后,发现d电极上覆盖一层红色物质。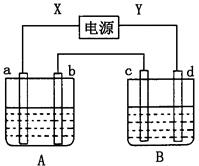
根据以上实验事实,回答下列问题:
(1)c极的电极反应式为 ;
(2)A槽中发生反应的离子方程式为;
(3)A槽中溶液的pH(填“变大”、“变小”或“不变”)。