(1)按已知的原子结构规律,82号元素X应是第___________周期_________族元素,它的最高正价氧化物的化学式为______________。
(2)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应_________填序号),写出反应⑥的化学方程式__ ____。
(3)在下列化合物中:H2O2 、Na2O、、I2 、、NaCl、、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是 ,
②只有极性共价键的共价化合物是 ,
③只含有非极性共价键的是 ,
④既有离子键又有非极性键的化合物是 。
将29g混合均匀的铁粉和硫粉置于密闭容器中加热,充分反应后冷却至室温,再跟足量稀盐酸反应,产生气体在标准状况下为8.4L,则混合物中铁和硫的物质的量之比为________。若使上述气体充分燃烧,可消耗标准状况下氧气的体积为___________。
麦秸杆、木屑等废料经干馏制燃料气过程中产生大量的废液,俗称木醋液(主要成分乙酸,还含少量的甲醇、苯酚、焦油等)。以木醋液与白云石(主要成分2MgCO3·3CaCO3,还含有SiO2等杂质)等为原料,可制备出绿色环保型融雪剂CMA(醋酸钙、醋酸镁固体的混合物)。
CMA生产流程如下:
(1)步骤①发生反应的离子方程式为 ________________。
(2)滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色焦油外,产生颜色的另一主要原因是 。
(3)步骤③是往滤液中加活性炭粉,可使滤液脱色,这是利用了活性炭具有 。
实验测知CMA中钙、镁离子的物质的量之比与出水率(与融雪效果成正比)的关系如图。
(4)由图知,当CMA中n(Ca2+)∶n(Mg2+)约为 时融雪的效果最好。(选填字母)
a.1∶2 b.3∶7 c.2∶3
步骤④的目的主要是 , 。
(5)步骤⑥包含的操作有 、过滤、洗涤及干燥。
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素。
(1)氯原子结构示意图是 ,碘在元素周期表中的位置是 ,HI的稳定性比HBr (填写“强”或“弱”)。
(2)向浓缩的海水中通入Cl2,可将Br-转化为Br2。再用“空气吹出法” 将Br2从浓海水中吹出,并用纯碱浓溶液吸收,生成NaBr、NaBrO3等。当有1 mol Br2被纯碱吸收时,转移的电子数为 。
下图是NaClO的发生装置。该装置主要利用了电解饱和食盐水的原理,可实现对海水的消毒和灭藻。
(3)写出装置中产生NaClO的化学方程式 。海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH) 2和CaCO3。生成CaCO3的离子方程式是 。若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。试用电极反应式并结合必要的文字进行解释 。
NaOH溶液吸收SO2得Na2SO3,可用Na2SO3吸收SO2。在SO2被吸收的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
1:91 |
| pH |
8.2 |
7.2 |
6.2 |
(4)从上表可判断,NaHSO3溶液呈 (填“酸性”、“碱性”、“中性”),请用平衡原理解释: 。
(5)当吸收液呈中性时,溶液中离子浓度关系正确的是 (选填字母)。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
d.c(Na+)>c(SO32-)>c(HSO3-)>c(H+)=c(OH-)
农业对化肥的需求是合成氨工业发展的持久推动力。
(1)氮原子最外电子层上有 种能量不同的电子,其原子核外存在 对自旋相反的电子。
(2)一定温度、压强下,氮气和氢气反应生成1mol氨气的过程中能量变化示意图如右,请写出该反应的热化学反应方程式: 。(Q的数值用含字母a、b的代数式表示)
下图表示500℃、60.0MPa条件下,原料气H2和N2的投料比与平衡时NH3体积分数的关系。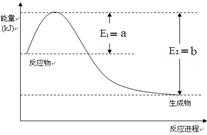
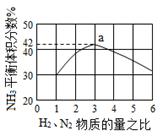
(3)工业上合成氨的温度一般控制在500℃,原因是 。
根据图中a点数据计算N2的平衡体积分数为 。
(4)硫化铵晶体与晶体硅相比较,____________的熔点较高,原因是___________。
(5)写出等物质的量浓度等体积的硫酸氢钠与硫化铵溶液反应的离子方程________________。
在25 ℃时,用石墨电极电解2.0 L 0.5mol·L-1 CuSO4溶液。5min后,在一个石墨电极上有6.4 g Cu生成。试回答下列问题。
(1)发生氧化反应的是__________极,电极反应式为____________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为____________。
(3)若将溶液恢复到与电解前一样,则需加入________mol的_______。