20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是
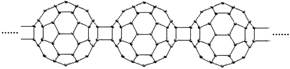
| A.X难溶于水 | B.一定条件下X可与H2发生加成反应 |
| C.X是碳的一种同素异形体 | D.X的摩尔质量为720n |
下列说法正确的是()
| A.含有羟基的化合物一定属于醇类 |
| B.代表醇类的官能团是与链烃基相连的羟基 |
| C.酚类和醇类具有相同的官能团,因而具有完全相同的化学性质 |
| D.分子内有苯环和羟基的化合物一定是酚类 |
下列分子式只能表示一种物质的是()
| A.C3H6Cl2 | B.C3H8 | C.C2H6O | D.C3H6 |
下列分子中所有原子不可能共平面的是 ( )
A. |
B. |
C. |
D. |
下列反应中,属于取代反应的是( )

| A.①② | B.③④ | C.①③ | D.②④ |
下列叙述中正确的是()
| A.糖类、油脂、蛋白质都是天然高分子化合物 |
| B.利用油脂在酸性条件下水解,可以生产甘油和肥皂 |
| C.淀粉与纤维素分子式都为(C6H10O5)n而结构不同,二者互为同分异构体 |
| D.可用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸 |