碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。 (1)现采用氢气还原法,请回答如下问题:
(1)现采用氢气还原法,请回答如下问题: ①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ;
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式 ; ②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号): (a)→()()→()()→()()→()()→()()→(l)
(a)→()()→()()→()()→()()→()()→(l)

 ③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ;
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为 ; (2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 ;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。 ;
某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
| 实验操作 |
实验现象 |
|
| 步骤1 |
在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 |
有少量气泡产生,溶液的黄绿色褪去 |
| 步骤2 |
将第一份滤液与稀盐酸混合 |
产生大量气泡 |
| 步骤3 |
将第二份滤液加热 |
溶液变浑浊,且有大量无色气体产生 |
⑴步骤 1中发生反应的离子方程式是____________________________________,
1中发生反应的离子方程式是____________________________________,
过滤的目的是____________________________________________________。
⑵步骤2、步骤3的实验目的都是_____________________________,为达到该实验目的,还可以采取的方法是______________________________________。
⑶步骤3中反应的离子方程式是:。
(4)请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:_____________________________________________________。
在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。某同学利用铁与水蒸气反应后的固体物质进行了如下实验:
(1)铁粉与水蒸气反应的化学方程式是:
(2)证明还原铁粉与水蒸气发生了反应的方法是
(3)固体溶于稀盐酸的化学方程式为。
(4)试剂1的化学式是。
(5)加入新制氯水后溶液红色加深的原因是(用离子方程式表示)
;
(6)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色原因进行探究。
①提出假设:
假设1:溶液中的+3价铁被氧化为更高的价态;
假设2:;
②设计方案:
为了对你所提出的假设2进行验证,实验方案是
。
我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下: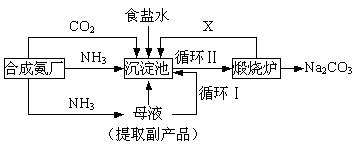

沉淀池中四种盐在不同温度下的溶解度(g / 100 g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
| NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
| NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
| NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
| NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)沉淀池中反应温度控制在30℃~35℃,是因为若高于35℃,则,若低于30℃,则;为控制此温度范围,采取的加热方法为。
(2) 沉淀池中发生的化学反应方程式是。
(3)副产品的一种用途为,写出上述流程中X物质的分子式。
(4)加料完毕后,继续保温30分钟,目的是。静置后只析出NaHCO3晶体的原因是。用蒸馏水洗涤NaHCO3晶体的目的是除去杂质(以化学式表示)。
(5) 为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加。
如图所示,将甲、乙两 个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定,溶液浓度相同)。
个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定,溶液浓度相同)。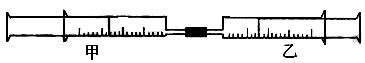
试回答下列问题:
| 实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
| 1 |
10mLFeSO4溶液 |
10mLNH3 |
生成白色沉淀,后变色 |
| 2 |
10mLAlCl3溶液 |
40mLNaOH溶液 |
|
| 3 |
10mL紫色石蕊试液 |
25mLCl2 |
|
| 4 |
15molCl2 |
40mLNH3 |
⑴实验1中,沉淀最终变为色,写出沉淀变色的化学方程式。
⑵实验2甲针筒内的现象是:,写出有关反应的离子方程式:、。
⑶实验3甲针筒内的现象是:,反应后乙针筒内有少量的残留气体,正确的处理方法是将其通入溶液中 。
。
⑷实验4中,已知:3Cl2+2NH3=N2+6HCl。甲针筒除活塞有移动,针筒内有白烟产生外,气体的颜色变化为。
某次实验需用0.4 mo l·L-1 NaOH溶液480 mL。配制方法如下:
l·L-1 NaOH溶液480 mL。配制方法如下:
(1)配制该溶液应选用_______________mL容量瓶;
(2)用托盘天平准确称量__________g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约300 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待__________________后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯次,洗涤后的溶液___________________,轻轻晃动容量瓶,使 溶液混合均匀;
溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面________________________时,改用___________加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,______________________________;
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是___________,偏低的是___________,对实验结果没有影响的是___________(填各选项的序号)。
| A.所用的NaOH中混有少量Na2O |
| B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥 |
| C.配制溶液所用的容量瓶洗净后没有烘干 |
| D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作 |
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线。