(8分)(1)3.01×1022个OH-的物质的量为 质量为 ,这些OH-与 mol NH3的质量相等,与 g Na+含有的离子数相同;
⑵将4.6 g 金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与水反应能够放出标准状
金属钠在空气中充分燃烧得到淡黄色粉末,该粉末与水反应能够放出标准状
况下的气体 L,实验后所得溶液中Na+的物质的量为 ;
⑶同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的物质的量之比为 原子个数之比 。
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中: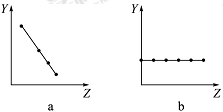

①ⅡA族元素的价电子数__________。
②第三周期元素的最高正价__________。
③F-、Na+、Mg2+、Al3+的离子半径__________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①化合物XN的化学式为________。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液均呈碱性,组成元素的原子数目之比均为1∶1∶1,B是家庭“84”消毒液的有效成份。则化合物A中的化学键类型为__________,B的化学式为。
③工业上制取单质M的化学方程式为。
A是一种常见的烃,标准状况下,A对氢气的相对密度是14。乳酸是一种常见的有机酸,用途广泛。高吸水性树脂F是一种高分子材料,可用于干旱地区抗旱保水、改良土壤、改造沙漠,还可制作尿不湿。下图是由A为原料制取高吸水性树脂F的合成路线图: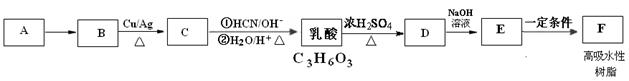
已知: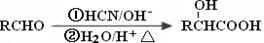
请回答:
(1)A的名称是,A B的反应类型是。乳酸中的官能团名称为
B的反应类型是。乳酸中的官能团名称为
(2)B  C的化学方程式是。
C的化学方程式是。
乳酸 D的化学方程式为
D的化学方程式为
(3)乳酸分子中核磁共振氢谱峰面积比是。乳酸有多种同分异构体,其中所含官能团与乳酸相同的为(用结构简式表示)
(4)一定条件下,乳酸经聚合可制得聚乳酸,聚乳酸在医疗上可做手术缝合线,聚乳酸的结构简式为
(5)F的结构简式为。
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
2Fe(s)+3CO2(g) ΔH =" a" kJ mol-1
(1)已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g)ΔH1 =" +" 489.0 kJ mol-1
②C(石墨)+CO2(g) = 2CO(g)ΔH2 =" +" 172.5 kJ mol-1
则a =kJ mol-1。
(2)冶炼铁反应的平衡常数表达式K =,温度升高后,K值(填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
| Fe2O3 |
CO |
Fe |
CO2 |
|
| 甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
| 乙/mol |
1.0 |
2.0 |
1.0 |
1.0 |
① 甲容器中CO的平衡转化率为。
② 下列说法正确的是(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。
①在a-c装置中,能保护铁的是(填字母)。
②若用d装置保护铁,X极的电极材料应是(填名称)。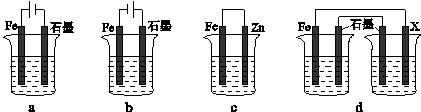
目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。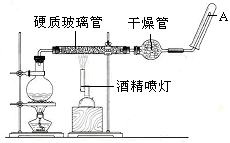
请回答下列的问题。
铁在周期表中的位置是_______
请写出该反应的化学方程式:;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
| ① |
② |
③ |
④ |
|
| 溶液中的金属离子 |
Fe2+ |
|||
| 残留固体成分 |
Fe、Pt |
Pt |
Pt |
②当x="0.5" ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mLNO。
则a =,b =,
氨在国民经济中占有重要地位。
(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为,生成的气体可以用蘸有浓盐酸的玻璃棒来检验,将产物溶于水,溶液呈酸性,用离子方程式表示原因;
溶液中离子浓度由大到小的顺序为
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如图,请结合化学用语从化学平衡的角度解释:
(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式。
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式___________________