已知反应:3I-(aq)+S2O82-(aq) I3-(aq)+2SO42- (aq)
I3-(aq)+2SO42- (aq)
(1)写出反应的平衡常数表达式K= ;
(2)右图表示反应过程中有关物质的能量,则反应的 0(填“>”、“<”或“=”);
0(填“>”、“<”或“=”);
(Ⅰ)、(Ⅱ)两线中,使用催化剂的是 线;
(3)反应中发生反应的I-与被氧化的I-的物质的量比为 ;
(4)反应的速率可以用 与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.160 |
c( )/mol·L-1 )/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.080 |
0.040 |
| t/s |
88 |
44 |
22 |
11 |
t1 |
则:该实验的目的是 ,显色时间t1= 分析表中数据,得出的结论是 。
常温下,如果取0.1mol·L-1HA溶液与0.1mol···L-1NaOH溶液等体积混合(不计混合后溶液体积的变化),测得混合液的pH=8,请回答下列问题:
(1)混合后溶液的pH=8的原因(用离子方程式表示):。
(2)混合溶液中由水电离出的c(H+)(填<、>、=)0.1mol·L-1NaOH溶液中由水电离出的c(H+)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Na+) -c(A-)=mol·L-1,c(OH-)-c(HA)=mol·L-1。
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7(填<、>、=);将同温下等物质的量浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2CO3 D.NH4Cl
按pH由大到小的顺序排列:(填序号)。
在水溶液中橙红色的Cr2O72—与黄色的CrO42—有下列平衡关系:
Cr2O72—+H2O 2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
2CrO42—+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈色,因为。
(2)向已加入NaOH溶液的(1)溶液中再加入过量稀H2SO4,则溶液呈色,
因为。
右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答: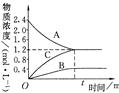
(1)该反应的反应物是。
(2)该反应的化学方程式是:。
(3)若达到平衡状态的时间为2min,则A的平均速率是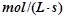 。
。
右下图是以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
| 实验后的记录: ①Zn极发生还原反应,Cu极发生氧化反应 ②H+向负极移动 ③电子流动方向Zn→导线→Cu ④溶液的pH变小 ⑤若有1mol电子流过导线,则产生H2为0.5mol。 ⑥正极的电极反应式:Zn-2e- =Zn2+ |

(1)在卡片上,叙述合理的是___ __(填序号)。
(2)其他条件相同情况下,产生气泡的速率比单一锌片(填快或慢)。
(3)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是___________________________。
(4)如果把硫酸换成硫酸铜溶液,猜测___(填“锌极”或“铜极”)变粗,原因是______(用电极方程式表示)。实验结束后称得两极质量差12.9g,假设初始时Zn极与Cu极质量相等,则反应中转移的电子的物质的量为mol。
有A、B、C、D、E五种元素,它们均为短周期元素。已知A是非金属性最强的元素,且E与A同族;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性。
(1)写出B元素的离子结构示意图;C2粒子的符号:;
(2)B、E两种元素形成化合物的电子式:
(3)A、E两种元素形成的氢化物沸点较高的是:(用化学式表示),
其原因是。
(4)写出D的气态氢化物与其最高价氧化物的水化物反应的离子方程式
(5)写出D的氢化物(过量)与E的单质发生氧化还原反应生成一种单质和一种盐的化学方程式。