下列离子方程式正确的是
| A.在稀氨水中通入过量CO2:NH3·H2O+CO2→NH4++HCO3- |
| B.向次氯酸钠溶液中通入少量的CO2:2ClO-+H2O+CO2→2HClO+CO32- |
| C.用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+→Cu2++2H2O |
| D.NH4HSO4溶液中加入足量Ba(OH)2溶液:H++SO42-+Ba2++OH-→BaSO4↓+H2O |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是()
A.1 mol 由元素A、B组成的化合物一定含有18 mole-
B.化合物AE与DE有相同类型的化学键
C.工业上常用电解法制备元素C、D、E的单质
D.元素D的最高价氧化物对应的水化物可以溶于过量的氨水中
下列实验操作、现象和解释都正确的是()
| 选项 |
实验操作 |
现象 |
解释 |
| A. |
向某溶液中加入盐酸 |
产生无色气体 |
溶液中一定含有CO32− |
| B. |
新制Fe(OH)2露置于空气中一段时间 |
白色固体迅速变为灰绿色,最终变为红褐色 |
说明Fe(OH)2易被氧化成Fe(OH)3 |
| C. |
在CuSO4溶液中加入KI溶液,再加入苯,振荡 |
上层呈紫红色,下层有白色沉淀生产 |
铜离子可以氧化碘离子,白色沉淀可能为CuI |
| D. |
向某无色溶液中滴加硝酸酸化的BaCl2溶液 |
产生白色沉淀 |
溶液中一定含有SO42- |
常温下,下列说法错误的是()
| A.pH=6的NaHSO4溶液:c(Na+)+ c(H+)= 2c(SO42-)+ c(OH-) |
| B.0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 |
| C.pH相同的①CH3COONa、②NaClO二种溶液的c(Na+):①>② |
| D.0.1 mol/L Na2SO3溶液:c(Na+)= 2c(SO32-)+ c(HSO3-)+ c(H2SO3) |
下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛。下列说法中正确的是()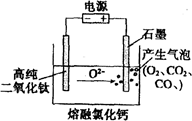
| A.阳极的电极反应式为:2Cl--2e-= Cl2↑ |
| B.通电后,O2-、Cl-均向阴极移动 |
| C.阴极的电极反应式为TiO2+4e-=Ti+2O2- |
| D.石墨电极的质量不发生变化 |
用NA表示阿伏加德罗常数,下列说法正确的是()
| A.2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1Na |
| B.1mol Na2CO3晶体中含CO32-离子数小于1NA |
| C.惰性电极电解食盐水,若线路中通过1NA电子电量,则阳极产生气体11.2L |
| D.0.1 mol的CaC2中含阴离子数是0.2 NA |