含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移方向和数目: 。
(2)Ba2+有剧毒。某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒。试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式 。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本 上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实
上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实 验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化;若铁棒表面 ,则未发生反应。
验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面 ,则发生了钝化;若铁棒表面 ,则未发生反应。
(4)用Na2SO3吸收法作为治理SO2污染的一种方法,其原理为(用化学方程式表示): 。
(5)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。该反应的化学方程式: 。
(6)制取硫酸铜有两种方法:方法一:2Cu+O2  2CuO,CuO+ H2SO4= CuSO4+H2O,
2CuO,CuO+ H2SO4= CuSO4+H2O,
方法二:Cu+ 2H2SO4(浓)
2H2SO4(浓) CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:
CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:
(答任一点)。
醛可以跟亚硫酸氢钠的饱和溶液发生加成反应,生成物是水溶性的α羟基磺酸钠: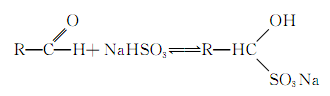
反应是可逆的,在通常条件下有70%~90%向正反应方向转化。
(1)若溴苯中混有杂质苯甲醛,欲将此杂质全部除去,可采用的试剂是__________________,其分离方法为__________________。
(2)若在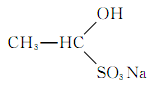 水溶液中加入足量盐酸,有机物转化为________,将该转化产物分离出来的常用方法是________。
水溶液中加入足量盐酸,有机物转化为________,将该转化产物分离出来的常用方法是________。
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。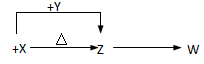
(1)W的电子式是____________ 。
(2)X与Y在溶液中反应的离子方程式是_______________ 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
①装置I中反应的化学方程式是_________ , 装置II中物质的化学式是 ____________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,该化合物的化学式是________ ,所需仪器装置是_________ (从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是 ______________。
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+Al3+ |
| 阴离子 |
SO42-HCO3-NO3- OH- |
为了鉴别上述化合物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:A,B,C,D,E
(2)在A溶液中加少入量澄清石灰水,其离子方程式为
(3)C常用作
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如图所示.则: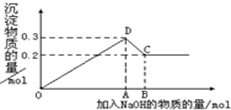
(1)写出代表各线段发生反应的离子方程式:
OD段
DC段
(2)原溶液中Mg2+、Al3+物质的量浓度之比为
(3)图中C点表示当加入molNaOH时,Al3+已经转变为,Mg2+已经转变为.
(4)图中线段OA:AB=
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、H3AsO4、H2O和一种未知物质X.
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是.
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为:.
(3)依据(2)的X写出该反应的完整的化学方程式:
(4)根据上述反应可推知
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:ASH3>X d.还原性:X>ASH3