自洁面料就是在普通的面料纤维中加入一层薄薄的纳米二氧化钛。含有Fe2O3的钛铁矿(主要成分为FeTiO3,Ti的最高价为+4)制取纳米级TiO2的流程如下: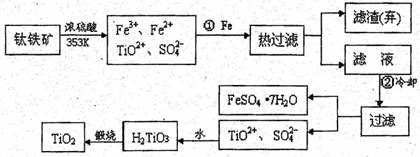
(1)步骤①发生的主要反应是 (用离子方程式表示)。
(2)上述制备二氧化钛的过程中,可以利用的副产物是 ;考虑成本和废物综合利用因素,废液中应加入 处理。
(3)由金红石制备单质钛,.涉及到的步骤为: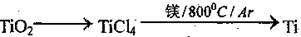
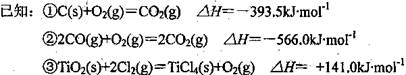
则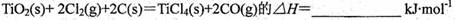
反应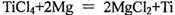 在氩气氛中进行的理由是 。 (4)TiO2是白色粉末,不溶于水,也不溶于酸,但能溶于氢氟酸和热的浓硫酸中。请写出TiO2与浓硫酸反应的化学方程式 。
在氩气氛中进行的理由是 。 (4)TiO2是白色粉末,不溶于水,也不溶于酸,但能溶于氢氟酸和热的浓硫酸中。请写出TiO2与浓硫酸反应的化学方程式 。
图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.2%。B的一氯代物仅有一种,B的结构简式为______________________________。
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为______________________________。
(3)写出由C生成D的化学方程式______________________________反应类型是__________,由G生成A的化学方程式______________________________反应类型是__________。由G生成F的化学方程式______________________________反应类型是__________。G发生催化氧化的化学方程式______________________________。
(4)F的核磁共振氢谱图有__________个吸收峰,峰面积之比为__________。
(1)一定条件下某烃与H2按物质的量之比1:2加成生成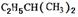 ,则该烃的结构简式为______________________________;
,则该烃的结构简式为______________________________;
(2)某有机物X分子中只含C、H、O三种元素,相对分子质量小于110,其中氧元素的质量分数为14.8%,已知该物质可与FeCl3溶液发生显色反应,则X的分子式为__________。
若1 mol X与浓溴水反应时消耗了3 mol Br2,则X的结构简式为____________________。
(3)分子式为C4H8的烃,核磁共振氢谱图中有两个吸收峰,峰面积比为3:1,请写出符合条件的所有物质的结构简式
(4)下列括号内为杂质,将除去下列各组混合物中杂质所需的试剂和方法填写在横线上。
① 溴乙烷(乙醇)____________________________________________________________
② 苯酚(苯)______________________________________________________________________
写出②操作中涉及到的反应的化学方程式________________________________________
(5)已知: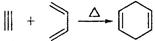 ,如果要合成
,如果要合成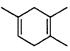 所用的原始原料可以是()
所用的原始原料可以是()
A.2-甲基-l,3-丁二烯和2-丁炔 B.2,3-二甲基-1,3-戊二烯和乙炔
C.2,3-二甲基-l,3-丁二烯和丙炔 D.1,3-戊二烯和2-丁炔
将下列有机物进行系统命名
①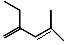 ____________________②
____________________②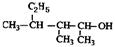 ____________________
____________________
A、B、C、D、E均为短周期元素,且原子序数依次增大。已知B元素在自然界中组成化合物的种类最多;D原子最外层电子数与核外电子数之比为3:4;A与D、E与D均可组成原子个数比为1:1和2:1的两种化合物。据此回答:
(1)由A、C、D三种元素可组成多种化合物,写出其中两种常见化合物的化学式。
(2)在C和B组成化合物 (CB)2中,C、B原子均满足最外层8电子结构,,则(CB)2的电子式是 。
(3)化合物E3C与水反应的原理和氮化镁与水反应的原理相同,写出E3C与盐酸反应的化学方程式。
(4)已知B与A可组成化合物甲,D与A可组成化合物乙,每个甲、乙分子中均含有18个电子
① 甲在过量的D单质中充分燃烧,燃烧热是1559 kJ / mol,写出该反应的热化学方程式。
② 在酸性条件下,向FeI2的淀粉溶液中加入乙,溶液变蓝。当1mol Fe2+被氧化成Fe3+时,反应中电子转移为4 mol,写出该反应的离子方程式_______________。
某些化学反应可用下式表示A+B→→C+D+H2O。请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
(3)若A、C均含有铝元素。①当B是盐酸时,C是 ;
②当B是NaOH时,C是 。