图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.2%。B的一氯代物仅有一种,B的结构简式为______________________________。
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为______________________________。
(3)写出由C生成D的化学方程式______________________________反应类型是__________,由G生成A的化学方程式______________________________反应类型是__________。由G生成F的化学方程式______________________________反应类型是__________。G发生催化氧化的化学方程式______________________________。
(4)F的核磁共振氢谱图有__________个吸收峰,峰面积之比为__________。
NaH2PO4是一种用途广泛的化工产品。工业上主要是以烧碱(或纯碱)中的磷酸生产,若能用氯化钠取代烧碱或纯碱来制取,则可使生产成本大大降低。但在通常条件下,氯化钠与磷酸之间的复分解反应不能自发进行,有研究者设计了用萃取法制取NaH2PO4的工艺:
萃取时主要反应如下:(S代表萃取剂,萃取剂对HCl的选择性比H3PO4好,主要萃取HCl)
①NaCl+H3PO4 NaH2PO4+HCl
NaH2PO4+HCl
②HCl+S HCl·S △H<0
HCl·S △H<0
③H3PO4+S H3PO4·S △H<0
H3PO4·S △H<0
(1)向H3PO4和NaCl溶液中加入萃取剂S后需要不断搅拌,搅拌的作用是。
(2)向操作I后所得的油层中加入适量氨水的目的是。
(3)下图是萃取温度对HCl萃取率的影响和H3PO4与NaCl物质的量比对HCl萃取率的影像图。
①当萃取温度低于40时,温度越低,萃取剂黏度越大,不利于HCl的萃取;当温度高于40℃时,HCl萃取率降低的原因是。
②从H3PO4与NaCl物质的量比对HCl萃取率的影像图中可以看出,适当提高H3PO4与NaCl物质的量比,会促进HCl的萃取。但H3PO4过量太多,会导致HCl的萃取率降低,其原因是。
(4)萃取法制取NaH2PO4的原理是。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,
还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸;c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是
否过量的简单实验方法是。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。
(Ⅰ)2SO2(g)+O2(g) 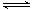 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: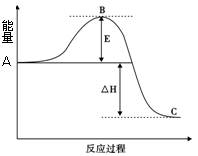
(1)图中A表示。
(2)E的大小对该反应的焓变有无影响?。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?。
(3)某温度下,向1L密闭容器中开始充入2molSO2和1molO2,在V2O5催化剂存在时反应达到平衡,压强减小为开始时的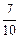 ;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g)
;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g) 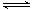 2SO2(g) + O2(g)的平衡常数(写出计算过程)
2SO2(g) + O2(g)的平衡常数(写出计算过程)
(Ⅱ)化学试剂的生产和电镀工业排放的废水中常含有20~100mg.L-1Cr(Ⅵ),饮用含Cr(Ⅵ)的水会损害人的肠胃等,已知Cr(Ⅲ)的毒性是Cr(Ⅵ)的0.5%,国家规定工业废水含Cr(Ⅵ)的量排放标准为0.1mg.L-1。工业上常用化学法和电解法处理含Cr(Ⅵ)废水,再将Cr(Ⅲ)转化成沉淀除去,某研究性学习小组为研究废水的净化,设计了如下实验流程: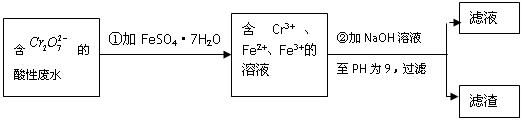
(1)配平第①步反应的离子方程式: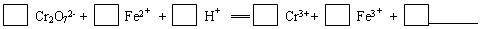
(2)第②步中用PH试纸测定溶液PH的操作是:
(3)设计一个电解装置也可以实现上述目的,装置如下图(用铁棒和石墨作电极):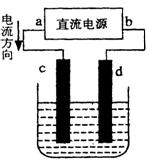
电极材料:c为:
电极反应:d极:
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
②CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:
请回答下列问题:
(1)基态Cu原子的核外电子排布式为,H、N、O三种元素的电负性由大到小的顺序是。
(2)SO2分子的空间构型为,与SnCl4互为等电子体的一种离子的化学式为。
(3)乙二胺分子中氮原子轨道的杂化类型为,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是。
(4)②中所形成的配离子中含有的化学键类型有。(填字母)
A配位键 B极性键 C离子键 D非极性键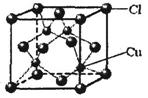
(5)CuCl的晶胞结构如上图所示,其中Cl原子的配位数为。
“空气质量日报”中空气污染指数的项目包含:SO2、CO、NO2、O3和可吸入颗粒物等。
(1)血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。
①写出亚铁离子的基态电子排布式。
②根据等电子体原理,1个CO分子中含有的π键数目为。
(2)为减轻SO2污染,火力发电厂生产中常在燃煤中加入CaO以“固硫”。科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其晶格能数据如下表:
①4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是。
②4种晶体的配位数均为。
(3)随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来越为人们所关注。
甲醛(HCHO)是室内主要空气污染物之一(其沸点是-19.5℃),甲醇(CH3OH)是“假酒”中的主要有害物质(其沸点是64.65℃),甲醇的沸点明显高于甲醛的主要原因
是:。甲醛分子中碳原子的杂化方式是。