A、B、C、D、E、F 六种物质有如下变化关系,E是淡黄色粉末,判断: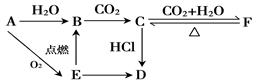
(1)写出下列物质的化学式:
A._____ _____; D.____________ ;
(2)写出有关反应的化学方程式(是离子反应的直接写离子方程式)
B―→C:_____________________________________
E―→B:________________________________________
C―→F:_________________________________________
F―→C:_____________________________________
(10分,每空2分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g)ΔH=−196.6 kJ·mol-1
2SO3(g)ΔH=−196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g)ΔH=−113.0 kJ·mol-1
2NO2(g)ΔH=−113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
(10分,每空2分)自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:
SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) △H1=-48.9 kJ·mol-1
SiF4(g)+ 2H2O(g) △H1=-48.9 kJ·mol-1
根据题意完成下列填空:
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。
a.一定向正反应方向移动b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,不正确的 (选填编号)。
a.2v正(HF)=v逆(H2O)b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。
(10分,每空1分)
(1)H2S溶于水的电离方程式 。
(2)向H2S溶液中加入CuSO4固体时,反应的离子方程式为 ,电离平衡向 (填“左”、“右”下同)移动, c(H+)________(填“增大”、“减小”、“不变”下同),c(S2-) 。
(3)向H2S溶液中加入NaOH溶液时,电离平衡向_________移动, c(H+)________,n(S2-)_________。
(4)若将H2S溶液加热至沸腾,c(H2S) 。
(5)向H2S溶液中加入NaCl溶液时,n(H+) 。
某过氧化氢水溶液10g,氢原子和氧原子的个数比为5∶3。则
(1)该溶液中氢元素的质量为 g;
(2)该溶液中H2O2的质量分数为 ;
(3)若在MnO2催化下该溶液全部反应,可以生成O2 L(标准状况)。
现有m g X气体,X由双原子分子构成,它的摩尔质量为M g•mol﹣1。若用NA表示阿伏加德罗常数的值,则:
(1)该气体的物质的量为 ;
(2)该气体中所含原子总数为 个;
(3)该气体在标准状况下的体积为 L;
(4)该气体溶于1L水中(不考虑反应),所得溶液密度为ρg•cm﹣3,溶液中X的物质的量浓度为 mol/L。
(5)已知X气体在水中易溶,通常1L水能溶解500L X气体。常温常压下将充满X气体的500mL集气瓶倒扣入足量水中,集气瓶中得到的溶液中X的物质的量浓度为 (常温常压下气体摩尔体积为Vm,不考虑集气瓶中溶液向水中扩散)。