(10分,每空2分)自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:
SiO2(s) +4HF(g) SiF4(g)+ 2H2O(g) △H1=-48.9 kJ·mol-1
SiF4(g)+ 2H2O(g) △H1=-48.9 kJ·mol-1
根据题意完成下列填空:
(1)在地壳深处容易有 气体逸出,在地壳浅处容易有 沉积。
(2)如果上述反应的平衡常数K值变大,该反应 (选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,不正确的 (选填编号)。
a.2v正(HF)=v逆(H2O) b.v(H2O)=2v(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为 。
某烃A 0.2mol在氧气中恰好完全燃烧,生成化合物B、C各1.0mol,试回答:
(1)烃A的分子式是____ ____。
(2)若取一定量的烃A充分燃烧后,生成B、C各2mol,则完全燃烧时消耗标准状况下的氧气的体积为_____L。
(3)若烃A能使溴水褪色,则A可能的结构有种,写出其中一种的结构简式___ __。
(4)若烃A能使溴水褪色,写出其最简单的同系物发生加聚反应的化学方程式___________。
(5)烃A与氢气发生加成反应的产物中,一氯代物有四种的结构简式为____。
甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲的单质与水反应的离子方程式为;
(2)乙元素在周期表中的位置为;
(3)丙元素的最高价氧化物的电子式为;
(4)甲与丁两种元素可组成的具有强氧化性的物质是。(填化学式)
下列各组物质(用序号填空):
① 金刚石和石墨;
②1H、2H、3H;
③ CH4和C10H22;
④乙烷和(CH3)2CHCH2CH3;
⑤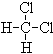 和
和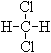 ;
;
⑥ CH3 (CH2) 3 CH3和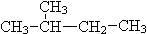
(1) 属于同一物质的是;
(2)互为同分异构体的是;
(3)互为同系物的是;
(4) 互为同素异形体的是;
(5) 互为同位素的是。
化学小组采用类似制乙酸乙酯的装置(如下图),用环己醇制备环己烯。
已知: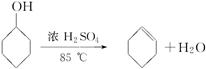
| 密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
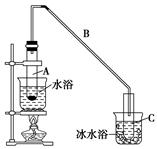
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片(防止爆沸),缓慢加热至反应完全,在试管C内得到环己烯粗品。
①导管B除了导气外还具有的作用是________。
②试管C置于冰水浴中的目的是______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4C.Na2CO3溶液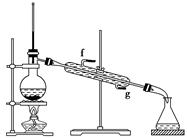
②再将环己烯按上图装置蒸馏,冷却水从________口进入(填“g”或“f”)。蒸馏时要加入生石灰,其目的是_____________________________________。
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________。
A.蒸馏时从70 ℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________。
A.分别加入酸性高锰酸钾溶液
B.分别加入用金属钠
C.分别测定沸点
来自石油的有机化工原料A,可以发生如下转化: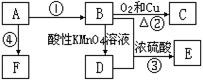
已知:E是具果香味的有机物,F是一种高分子化合物。请回答下列问题。
(1)A的分子式是_______________,C的名称是______________。
(2)D分子中的官能团名称是___________,证明 该官能团具有酸性的方法是________________________________________________________________________。
(3)反应③的化学方程式是_______________________________________________________,该反应属于____________反应。
反应④的化学方程式是 _______________________________________________________,该反应属于____________反应。